Доклад Совета Российской академии наук
Персонализированная медицина
cостояние научных исследований
и перспективы практического применения|
Персонализированная медицина (ПМ) хотя и находится сегодня на этапе становления, но уже представляет важный эволюционный шаг на пути создания лекарств, развития методов диагностики и профилактики. Со временем, благодаря применению в повседневной клинической практике концепции персонализированной медицины, во всем мире ожидается улучшение прогноза, точности диагностики и результатов терапии. Современное развитие молекулярных и информационных технологий в медицине привело к тому, что концепция персонализированной медицины переживает эпоху стремительного развития. За два десятилетия от узкой области применения в онкологии персонализированных лекарств, таких как герцептин, данная область расширилась до огромного перечня нозологий, возможностей точной предикации большинства болезней на основе широкогеномного скрининга, создания генотерапевтических препаратов, технологий модификации экспрессии генов и мощной информационно-аналитической системой сопровождения поиска индивидуальных предикторов ответа на лекарственные препараты.
Концепция персонализированной медицины диктует необходимость существенного изменения инфраструктуры биомедицинской науки, подчеркивает важность междисциплинарного подхода, направленного на более эффективное использование знаний, полученных в области геномики, инновационной биоинформатики и передовых нанотехнологических достижений, в клинической практике, т. е. на быструю трансляцию фундаментальных достижений в практическое здравоохранение. Для реализации концепции необходимо расширение приборной базы научных учреждений, развитие сети биобанков и центров коллективного пользования, информационных банков и библиотек, а также широкая международная интеграция. Еще важнее изменить суть и структуру подготовки кадров для последующей реализации технологий ПМ.
На базе концепции персонализированной медицины сегодня построено большинство инноваций: создание новых диагностических технологий на основе биомакеров; развитие индустрии таргетных препаратов; формирование фармакогенентики и фармакогеномики как новых направлений наук; развитие технологий редактирования генома; модификации микробиоты, нутритивной геномики и функционального питания и др. Большинство биотехнологических и фармацевтических компаний объявили в последние годы персонализированную медицину одной из основных стратегий развития на будущее, во многих странах и крупных научных центрах создаются консорциумы по персонализированной медицине, запускаются большие дорогостоящие проекты государственного масштаба, развиваются сервисы и определенная информационная среда, позволяющая привлекать все больше участников и тиражировать технологии.
Переход к персонализированному здравоохранению объявлен одним из приоритетов стратегического развития РФ на период до 2030 г. cтратегией научно-технологического развития РФ. В связи с высокой актуальностью проблемы Президиум РАН принял решение о создании Совета РАН по персонализированной медицине, который в рамках своей работы подготовил данный аналитически доклад для актуализации современных направлений исследований и разработок, состояния уровня исследований в России и сопоставление с мировым уровнем, определения приоритетов и стратегических направлений развития науки, внедрения ПМ в практику и подготовки кадров.
Концепция персонализированной медицины диктует необходимость существенного изменения инфраструктуры биомедицинской науки, подчеркивает важность междисциплинарного подхода, направленного на более эффективное использование знаний, полученных в области геномики, инновационной биоинформатики и передовых нанотехнологических достижений, в клинической практике, т. е. на быструю трансляцию фундаментальных достижений в практическое здравоохранение. Для реализации концепции необходимо расширение приборной базы научных учреждений, развитие сети биобанков и центров коллективного пользования, информационных банков и библиотек, а также широкая международная интеграция. Еще важнее изменить суть и структуру подготовки кадров для последующей реализации технологий ПМ.
На базе концепции персонализированной медицины сегодня построено большинство инноваций: создание новых диагностических технологий на основе биомакеров; развитие индустрии таргетных препаратов; формирование фармакогенентики и фармакогеномики как новых направлений наук; развитие технологий редактирования генома; модификации микробиоты, нутритивной геномики и функционального питания и др. Большинство биотехнологических и фармацевтических компаний объявили в последние годы персонализированную медицину одной из основных стратегий развития на будущее, во многих странах и крупных научных центрах создаются консорциумы по персонализированной медицине, запускаются большие дорогостоящие проекты государственного масштаба, развиваются сервисы и определенная информационная среда, позволяющая привлекать все больше участников и тиражировать технологии.
Переход к персонализированному здравоохранению объявлен одним из приоритетов стратегического развития РФ на период до 2030 г. cтратегией научно-технологического развития РФ. В связи с высокой актуальностью проблемы Президиум РАН принял решение о создании Совета РАН по персонализированной медицине, который в рамках своей работы подготовил данный аналитически доклад для актуализации современных направлений исследований и разработок, состояния уровня исследований в России и сопоставление с мировым уровнем, определения приоритетов и стратегических направлений развития науки, внедрения ПМ в практику и подготовки кадров.
Schwab K. The Fourth Industrial Revolution. World Economic Forum. New York, NY: Crown Publishing Group, 2017
Personalized Medicines Fact Sheet. Genes to personalized medicines. Progress from the National Institute of General Medical Sciences. National Institute of Health ↗
U.S. News & World Report LP. 2011
Personalized Medicines Fact Sheet. Genes to personalized medicines. Progress from the National Institute of General Medical Sciences. National Institute of Health ↗
U.S. News & World Report LP. 2011
Стратегия научно-технологического развития Российской Федерации (утверждена Указом Президента Российской Федерации от 1 декабря 2016 г. N 642).
Определение понятий
Идеология ПМ была заложена задолго до того, как этот термин вошел в практику здравоохранения, а во главу были поставлены генетические риски заболеваний и генетические предикторы ответа на терапию.
Черпая свои истоки еще в античной философии и медицине, исторически индивидуальный подход к лечению пациента был ключевым звеном русской медицинской школы 19 в. Стремление лечить «не болезнь, а больного», провозглашенное М.Я. Мудрым, развитие этой идеологии С.П. Боткиным и другими лучшими представителями отечественной школы терапии, как никогда актуально звучат в современном мире, когда концепция индивидуального подхода начинает вновь побежать идеологию преувеличенной догмы доказательной медицины, основывающейся только на «диктатуре» клинических исследований и статистики. При этом современная концепция ПМ давно вышла за рамки геномики и молекулярной биологии и предполагает широкие возможности осуществления адресной профилактики, диагностики и лечения заболеваний и продления жизни каждого человека.
В настоящее время мы находимся в начале четвертой индустриальной революции и формирования не просто постиндустриального общества, а общества, основанного на глубоких научных знаниях. Биоинформатика, биология, медицина и в целом «науки о жизни» стали сегодня самыми сильными драйверам изменения жизни общества. Сочетание неограниченных возможностей хранения и обработки данных, стремительного развития аналитических методов и возможности перевода процессов анализа в режим реального времени не только изменяют производственные процессы, социальную жизнь, но и открывают возможность радикального изменения всех процессов в здравоохранении, начиная с общественного здоровья и заканчивая персонализированной медицинской помощью. В то же время такое быстрое развитие технологий несет в себе определенные угрозы, в том числе риски внедрения технологий, не доказавших свою безопасность и эффективность, и дискриминации определенных групп населения за счет доступа разного рода пользователей к их персональным данным и, наоборот, ограничения их доступа к новым технологиям. В связи с этим применение персонализированных технологий так же, как и любая другая инновация в медицине, нуждается в серьезных научных доказательствах и в проверке практикой.
Термин «персонализированная медицина» (или индивидуализированная, персонифицированная) стал популярен в конце 20 – начале 21 вв. Он предполагает выбор лечения, основанный на учете индивидуальных особенностей пациента, в первую очередь генетических, а также половозрастных, антропометрических, этнических, особенностях окружающей среды и др. Этот принцип в корне отличает ПМ от концепции «стандартизованного лечения», основанного на результатах клинических испытаний и больших когортных исследований. В узком смысле ПМ первоначально фокусировалась на потенциале геномных маркеров (вариантов нуклеотидной последовательности) для формирования идей по стратификации риска, профилактике, подбору доз препаратов, выбора препаратов, предсказания терапевтического ответа и исхода. Это предполагало развитие двух основных направлений – изучение редких заболеваний с очевидной генетической природой и частых заболеваний с генетической предрасположенностью. В дальнейшем спектр биомаркеров стал расширяться, появились новые направления, такие как персонифицированные клеточные продукты, технологии редактирования генома, антисмысловая терапия, что привело к созданию сложной современной архитектуры ПМ и выделение в ней большого количество различных направлений.
Эволюция и расширение концепции персонализированной медицины привело к появлению термина «прецизионная» (или точная медицина), которая предполагает выявление группу людей (вплоть до отдельных индивидуумов), которые имеют какие-то общие пути особенностей развития заболеваний и ответа на терапию. Этот термин Национальным научным советом США в 2011 г. был признан официально более корректным и частично заменяющим ПМ. Прецизионная медицина – область медицины, учитывающая индивидуальные различия в генах, микробиомах, среде, семейного анамнеза и образе жизни для определения стратегии диагностики, лечения и профилактики, точно направленных на конкретного пациента. Эти понятия близкие, но не тождественные. Прецизионная (точная) медицина предполагает поиск вероятностных рисков или вероятности того или иного вмешательства принести большую или меньшую пользу в отношении исхода у какой-то группы больных с общими характеристиками (например, генами). Тогда как истинная персонализация медицинской помощи наблюдается только в том случае, когда роль биомаркеров и факторов риска накладывается на предпочтения и потребности конкретного пациента, включая его семью, характер, ожидания и особенности межличностного взаимодействия с лечащим врачом.
Фармакгеномика, фармакогенетика и фармакопроеомика остаются ведущими разделами ПМ, основываясь на молекулярной диагностике, как на жизненно важном инструменте для ПМ. Большинство современных лекарств разработаны и одобрены на основе их эффективности в больших группах пациентов. Первоначальной концепцией создания лекарств было представление о том, что при наличии понятного механизма тот или ной ответ на лечение будет наблюдаться у всех пациентов. Классические данные клинических испытаний нового препарата просто оценивали средний ответ исследуемой группы (среднее снижение уровня АД, холестерина, уменьшение в размерах опухли, достижение ремиссии, уменьшение боли и др.). Хотя индивидуализация некоторых методов лечения была предложена уже в прегеномную эпоху (концепция персонализированной медицины), которая развивается в современном обществе, основывается на достижениях в молекулярной диагностике и разработке лекарств на основе геномики, протеомики, метаболомики и биомаркеров. Цель персонализированной фармакотерапии состоит не только в том, чтобы подобрать правильный препарат нужному пациенту, а подобрать его, не прибегая к пробному лечению, на основе знаний о генотипе и уровне биомаркеров. Это повышает эффективность и безопасность лечения и закономерно снижает его стоимость.
Существует немало терминов и определений, которые имеют тесную связь с ПМ. Термин устоялся после опубликования первой одноименной монографии в 1998 г. и тогда же появляется среди ключевых слов, индексируемых в системе MEDLINE с 1999 г., но длительное время ассоциировался только с областями фармакогеномики.
Черпая свои истоки еще в античной философии и медицине, исторически индивидуальный подход к лечению пациента был ключевым звеном русской медицинской школы 19 в. Стремление лечить «не болезнь, а больного», провозглашенное М.Я. Мудрым, развитие этой идеологии С.П. Боткиным и другими лучшими представителями отечественной школы терапии, как никогда актуально звучат в современном мире, когда концепция индивидуального подхода начинает вновь побежать идеологию преувеличенной догмы доказательной медицины, основывающейся только на «диктатуре» клинических исследований и статистики. При этом современная концепция ПМ давно вышла за рамки геномики и молекулярной биологии и предполагает широкие возможности осуществления адресной профилактики, диагностики и лечения заболеваний и продления жизни каждого человека.
В настоящее время мы находимся в начале четвертой индустриальной революции и формирования не просто постиндустриального общества, а общества, основанного на глубоких научных знаниях. Биоинформатика, биология, медицина и в целом «науки о жизни» стали сегодня самыми сильными драйверам изменения жизни общества. Сочетание неограниченных возможностей хранения и обработки данных, стремительного развития аналитических методов и возможности перевода процессов анализа в режим реального времени не только изменяют производственные процессы, социальную жизнь, но и открывают возможность радикального изменения всех процессов в здравоохранении, начиная с общественного здоровья и заканчивая персонализированной медицинской помощью. В то же время такое быстрое развитие технологий несет в себе определенные угрозы, в том числе риски внедрения технологий, не доказавших свою безопасность и эффективность, и дискриминации определенных групп населения за счет доступа разного рода пользователей к их персональным данным и, наоборот, ограничения их доступа к новым технологиям. В связи с этим применение персонализированных технологий так же, как и любая другая инновация в медицине, нуждается в серьезных научных доказательствах и в проверке практикой.
Термин «персонализированная медицина» (или индивидуализированная, персонифицированная) стал популярен в конце 20 – начале 21 вв. Он предполагает выбор лечения, основанный на учете индивидуальных особенностей пациента, в первую очередь генетических, а также половозрастных, антропометрических, этнических, особенностях окружающей среды и др. Этот принцип в корне отличает ПМ от концепции «стандартизованного лечения», основанного на результатах клинических испытаний и больших когортных исследований. В узком смысле ПМ первоначально фокусировалась на потенциале геномных маркеров (вариантов нуклеотидной последовательности) для формирования идей по стратификации риска, профилактике, подбору доз препаратов, выбора препаратов, предсказания терапевтического ответа и исхода. Это предполагало развитие двух основных направлений – изучение редких заболеваний с очевидной генетической природой и частых заболеваний с генетической предрасположенностью. В дальнейшем спектр биомаркеров стал расширяться, появились новые направления, такие как персонифицированные клеточные продукты, технологии редактирования генома, антисмысловая терапия, что привело к созданию сложной современной архитектуры ПМ и выделение в ней большого количество различных направлений.
Эволюция и расширение концепции персонализированной медицины привело к появлению термина «прецизионная» (или точная медицина), которая предполагает выявление группу людей (вплоть до отдельных индивидуумов), которые имеют какие-то общие пути особенностей развития заболеваний и ответа на терапию. Этот термин Национальным научным советом США в 2011 г. был признан официально более корректным и частично заменяющим ПМ. Прецизионная медицина – область медицины, учитывающая индивидуальные различия в генах, микробиомах, среде, семейного анамнеза и образе жизни для определения стратегии диагностики, лечения и профилактики, точно направленных на конкретного пациента. Эти понятия близкие, но не тождественные. Прецизионная (точная) медицина предполагает поиск вероятностных рисков или вероятности того или иного вмешательства принести большую или меньшую пользу в отношении исхода у какой-то группы больных с общими характеристиками (например, генами). Тогда как истинная персонализация медицинской помощи наблюдается только в том случае, когда роль биомаркеров и факторов риска накладывается на предпочтения и потребности конкретного пациента, включая его семью, характер, ожидания и особенности межличностного взаимодействия с лечащим врачом.
Фармакгеномика, фармакогенетика и фармакопроеомика остаются ведущими разделами ПМ, основываясь на молекулярной диагностике, как на жизненно важном инструменте для ПМ. Большинство современных лекарств разработаны и одобрены на основе их эффективности в больших группах пациентов. Первоначальной концепцией создания лекарств было представление о том, что при наличии понятного механизма тот или ной ответ на лечение будет наблюдаться у всех пациентов. Классические данные клинических испытаний нового препарата просто оценивали средний ответ исследуемой группы (среднее снижение уровня АД, холестерина, уменьшение в размерах опухли, достижение ремиссии, уменьшение боли и др.). Хотя индивидуализация некоторых методов лечения была предложена уже в прегеномную эпоху (концепция персонализированной медицины), которая развивается в современном обществе, основывается на достижениях в молекулярной диагностике и разработке лекарств на основе геномики, протеомики, метаболомики и биомаркеров. Цель персонализированной фармакотерапии состоит не только в том, чтобы подобрать правильный препарат нужному пациенту, а подобрать его, не прибегая к пробному лечению, на основе знаний о генотипе и уровне биомаркеров. Это повышает эффективность и безопасность лечения и закономерно снижает его стоимость.
Существует немало терминов и определений, которые имеют тесную связь с ПМ. Термин устоялся после опубликования первой одноименной монографии в 1998 г. и тогда же появляется среди ключевых слов, индексируемых в системе MEDLINE с 1999 г., но длительное время ассоциировался только с областями фармакогеномики.
Очень близкими понятиями (отраслями ПМ на современном этапе) являются термины:
- genomic medicine – геномная медицина;
- genotype-based therapy – терапия, основная на генотипе;
- individualized medicine или individual-based therapy – индивидуализированная медицина;
- information-based medicine – медицина, основанная на информации;
- omics-based medicine – медицина, основанная на омиксных технологиях (фармакогеномике, фаркмакопротеомике, фармакометаболомике);
- pharmacogenomics / pharmacogenetics / pharmacoproteomics / pharmacometabolomics – фрамакогеномика/фармакогенетика/фармакопротеомика/фармакометаболомика;
- precision medicine – прецизионная (точная) медицина;
- rational drug selection – рациональный выбор лекарств;
- stratified medicine – стратифицированная медицина;
- systems medicine – системная медицина.
Biomedical Research and aNew Taxonomy of Disease. Washington, DC: The National Academies Press, 2011
Kirchhof P., Sipido K.R., Cowie M.R. et al. The continuum of personalized cardiovascular medicine: a position paper of the European Society of Cardiology // Eur Heart J. 2014;35(46): 3250-3257
Senn S. Mastering variation: variance components and personalised medicine // Stat Med 2016; 35:966–977
Pan S., Knowles J.W. Exploring predisposition and treatment response – the promise of genomics // Prog Cardiovasc Dis. 2012;55(1):56-63
Pan S., Knowles J.W. Exploring predisposition and treatment response – the promise of genomics // Prog Cardiovasc Dis. 2012;55(1):56-63
National Research Council (US) Committee on A Framework for Developing a New Taxonomy of Disease. Toward Precision Medicine: Building a Knowledge Network for Biomedical Research and a New Taxonomy of Disease. Washington (DC): National Academies Press (US); 2011. PMID: 22536618
National Research Council (US) Committee on A Framework for Developing a New Taxonomy of Disease. Toward Precision Medicine: Building a Knowledge Network for Biomedical Research and a New Taxonomy of Disease. Washington (DC): National Academies Press (US); 2011. PMID: 22536618
Hwang J., Christensen C.M. Disruptive innovation in health care delivery: a framework for business-model innovation. Health Aff (Millwood). 2008 Sep-Oct;27(5):1329-35. DOI: 10.1377/hlthaff.27.5.1329. PMID: 18780919
Hwang J., Christensen C.M. Disruptive innovation in health care delivery: a framework for business-model innovation. Health Aff (Millwood). 2008 Sep-Oct;27(5):1329-35. DOI: 10.1377/hlthaff.27.5.1329. PMID: 18780919
Mayo clinic staff. Pharmacogenomics: when medicine gets personal. Mayo Foundation for Medical Education and Research (MFMER). July 16, 2010
Jain K.K. Personalized medicine. Waltham: Decision Resources Inc, 1998
Таблица: Различные варианты определения персонализированной медицины
Основные преимущества персонализированной медицины и барьеры на пути внедрения
Можно выделить следующие преимущества ПМ:
Однако сделать правдивый прогноз о том, насколько внедрение ПМ приведет к снижению затрат на здравоохранение, сегодня достаточно сложно. Чтобы внедрить подходы в реальную клиническую практику, необходимы очень большие вложения в изменение структуры медицинской помощи: в лабораторное и информационное оснащение; повышение квалификации медицинский работников; систему оценки качества помощи и даже в клинические рекомендации и протоколы лечения заболеваний. Еще ни одна страна не может сказать, сколько это займет времени и насколько широко это возможно в ближайшем будущем. К сожалению, опыт последних десятилетий показывает, что стоимость медицинской помощи во всем мире только возрастает, поэтому к сиюминутному повсеместному внедрению ПМ стоит относиться без слепого энтузиазма и даже с должной степенью скептицизма. Реальная экономическая эффективность прецизионных подходов к лечению будет видна спустя значительный период времени, требует постоянной оценки и переосмысления. К сожалению, существуют риски, что широкое внедрение дополнительных методов обследования, в том числе определение новых генетических маркеров, на начальном этапе только увеличит расходы на здравоохранение. В лечении опухолей и ряда других патологий таргетные препараты обладают очень высокой стоимостью, тогда как их преимущества в плане отдаленного прогноза зачастую еще требует уточнения. Даже такой революционный подход в лечении гиперлипидемии, как ингибиторы PCSK9, уже некоторыми экспертами считается спорным достижением с точки зрения соотношения эффективности и стоимости. В связи с этим внедрение методов и технологий ПМ во всем мире происходит постепенно от областей с высокой степенью доказанности результата к более спорным отраслям.
- более взвешенные медицинские решения на основании более глубинного понимания механизмов болезни и действия лекарств;
- повышение вероятности хорошего прогноза за счет более таргетного воздействия;
- снижение вероятности побочных эффектов лекарств и других ятрогенных осложнений;
- концентрация на профилактике, в том числе индивидуально обоснованной;
- раннее начало лечения болезней на основании более чувствительных маркеров, в том числе возможность лечения до появления симптомов;
- пренатальная диагностика генетических дефектов и профилактика детской инвалидности.
Однако сделать правдивый прогноз о том, насколько внедрение ПМ приведет к снижению затрат на здравоохранение, сегодня достаточно сложно. Чтобы внедрить подходы в реальную клиническую практику, необходимы очень большие вложения в изменение структуры медицинской помощи: в лабораторное и информационное оснащение; повышение квалификации медицинский работников; систему оценки качества помощи и даже в клинические рекомендации и протоколы лечения заболеваний. Еще ни одна страна не может сказать, сколько это займет времени и насколько широко это возможно в ближайшем будущем. К сожалению, опыт последних десятилетий показывает, что стоимость медицинской помощи во всем мире только возрастает, поэтому к сиюминутному повсеместному внедрению ПМ стоит относиться без слепого энтузиазма и даже с должной степенью скептицизма. Реальная экономическая эффективность прецизионных подходов к лечению будет видна спустя значительный период времени, требует постоянной оценки и переосмысления. К сожалению, существуют риски, что широкое внедрение дополнительных методов обследования, в том числе определение новых генетических маркеров, на начальном этапе только увеличит расходы на здравоохранение. В лечении опухолей и ряда других патологий таргетные препараты обладают очень высокой стоимостью, тогда как их преимущества в плане отдаленного прогноза зачастую еще требует уточнения. Даже такой революционный подход в лечении гиперлипидемии, как ингибиторы PCSK9, уже некоторыми экспертами считается спорным достижением с точки зрения соотношения эффективности и стоимости. В связи с этим внедрение методов и технологий ПМ во всем мире происходит постепенно от областей с высокой степенью доказанности результата к более спорным отраслям.
O'Donnell C.J., Nabel E.G. Cardiovascular genomics, personalized medicine, and the National Heart, Lung, and Blood Institute: part I: the beginning of an era // Circ Cardiovasc Genet. 2008;1(1): 51-57
Структура персонализированной медицины
Сегодня персонализированная медицина включает в себя несколько стратегических направления инноваций в медицине:
Частные вопросы ПМ в диагностике и лечении заболеваний привели к самостоятельным наукам, которые активно развиваются в соответствующих областях. Среди них максимальные достижения достигнуты по следующим направлениям ПМ:
- персонализированная диагностика, включая науку о биомаркерах;
- персонализированная профилактика;
- нанотехнологии и наноустройства;
- персонализированные информационные технологи в медицине, вычислительные инструменты и трансляционная биоинформатика, искусственный интеллект;
- персонализированная фармакология, в том числе персонализированная биологическая терапия;
- персонализированные клеточные продукты и генные препараты.
Частные вопросы ПМ в диагностике и лечении заболеваний привели к самостоятельным наукам, которые активно развиваются в соответствующих областях. Среди них максимальные достижения достигнуты по следующим направлениям ПМ:
- в онкологии;
- психиатрии и лечении неврологических расстройства;
- лечении ССЗ;
- болезни метаболизма;
- аутоиммунные и аутовоспалительные заболевания;
- перинатология и наследственные болезни, репродукция;
- образ жизни;
- лечение инфекций
Факторы, способствующие развитию персонализированной медицины:
- растущий запрос и общественное давление на правительство в целях внедрения более безопасных и эффективных методов лечения;
- запрос в отношении фармацевтической отрасли и медицинской промышленности – снижение побочных эффектов лекарств и числа ятрогенных осложнений;
- стремление бизнеса сделать генетический скрининг более распространенным;
- повышение требований к качеству медицинской помощи, стимулирующее медицинских работников искать гарантии безопасности;
- запрос на снижение стоимости медицинской помощи за счет сокращения потерь на неэффективную лекарственную терапию, лечение последствия ятрогенных осложнений;
- снижение стоимости генетических тестов, в том числе секвенирования генома.
- доступность геномных знаний, полученных в результате секвенирования генома человека;
- наличие новых технологий, позволяющих широко и повсеместно применять ПМ (биочипы и высокопроизводительное секвенирование);
- смена поколений медицинских работников на молодое поколение, повышение осведомленности о фармакогеномике, фармакогенетике и молекулярной медицине;
- внедрение ПМ в научных медицинских центрах
- распространение биотехнологических компаний, заинтересованных в ПМ;
- увеличение числа компаний, сочетающих диагностику с терапией (тераностика);
- стремление компаний повысить надежность и безопасность своей продукции, снизить репутационные потери при развитии неэффективности или побочных действий;
- развитие ценностной медицины и концепции разделения рисков (risk-sharing)
Одним из важнейших условий для развития ПМ является валидация и внедрение новых биомаркеров. Процесс создания нового биомакера включает направления, которые активно развиваются в настоящее время и будут совершенствоваться в будущем:
- обнаружение маркера и его валидация;
- оценка предиктивного потенциала и сопоставление с другими маркерами;
- доклинические и клинические исследования;
- животные модели;
- биоинформатическая обработка генетических данных;
- подходы на основе принципов системной биологии.
Будущее персонализированной медицины
Быстрая эволюция биомедицины приведет к серьезным изменениям в здравоохранении в самое ближайшее время. В частности, реальные молекулярные механизмы большинства заболеваний, которые ранее считались идиопатическими и неясными, будут расшифрованы и детализированы. На основе омиксных данных будет создано большое число медицинских сервисов, в том числе коммерческих, которые будут широко развиваться и предлагаться населению не только медицинскими учреждениями. Геномные данные и системы калькуляции рисков будут постепенно интегрироваться в клиническую медицину. Со временем будут решены этические и регуляторные проблемы внедрения передовых генетических технологий, и они быстро войдут в практическую деятельность. Ожидается бурное развитие наномедицины и «медицины связи» (Connected Health), которая подразумевает использование для диагностики и мониторинга огромного множества дистанционных сервисов связи, обеспечивающих сосредоточение беспроводных, мобильных, электронных и других сервисов, созданных для нужд пациента, что позволит пациенту поделиться этими данными в целях получения максимально эффективного медицинского сопровождения.
Огромный рывок совершит профилактическая медицина, и это должно увенчаться успехами в лечении заболеваний в доклинической стадии и созданием других технологий лечения «до болезни».
Автоматизация, роботизация, системы поддержки принятия решений и предиктивная аналитика прочно войдут в клиническую практику и приведут к серьезной трансформации функций врача и других медицинских работников. Сочетание информатизации и технологий искусственного интеллекта с прогрессом в молекулярной биологии приведет не только к созданию «умного» здравоохранения, но и к истинно индивидуализированному подходу, включая питание, физическую активность, назначение лекарств и прочих методов лечения.
Подобную трансформацию медицины следует ожидать в области онкологии, нейронаук и лечения вирусных инфекций, где достижения молекулярной биологии уже наиболее заметны. Считается, что технологии ПМ в этих сферах будут широко применяться к 2025 г. Не только новые таргетные препараты будут создаваться с учетом персонализации, но и применение многих известных молекул и технологий будет уточнено на основании данных геномики и протеомики. Существует мнение, что генотипирование станет «рентгеном 21 века», что основано на представлении о роли генетических тестов в предикции заболеваний, точной диагностике, выборе лечения и прогнозе.
Не все заболевания быстро потребуют персонализированного лечения, эта область будет развиваться постепенно и охватывать новые направления. Но важно осознать, что мы не должны ждать еще десятки лет, чтобы войти в эру персонифицированной медицины, мы должны уже активно внедрять ее принципы в клинические рекомендации и протоколы лечения, в практическую жизнь, что активно происходит во многих системах здравоохранения. Ожидается большой прогресс в биофармацевтическом секторе в этой сфере, что обеспечит генерацию инноваций и новых научных знаний. Для многий стран, таких как США, Япония и Китай, стратегия ПМ стала мейнстримом государственной политики в области здравоохранения, что подробно изложено в настоящем докладе. Крайне важно, что в рамках Национального проекта «Наука» много внимания уделено геномным исследованиям и ПМ. Это станет существенным стимулом к развитию этого направления в РФ.
Переход к ПМ обозначен во всех стратегических документах по науке и инновациям, находится в пике финансирования проектов, включен во все приоритеты и является предметом наиболее активного обсуждения в профессиональном сообществе РФ. Тем не менее остаются нерешенные проблемы, которые Совет РАН обозначает в настоящем докладе и призван отчасти решить в рамках своей деятельности:.
Огромный рывок совершит профилактическая медицина, и это должно увенчаться успехами в лечении заболеваний в доклинической стадии и созданием других технологий лечения «до болезни».
Автоматизация, роботизация, системы поддержки принятия решений и предиктивная аналитика прочно войдут в клиническую практику и приведут к серьезной трансформации функций врача и других медицинских работников. Сочетание информатизации и технологий искусственного интеллекта с прогрессом в молекулярной биологии приведет не только к созданию «умного» здравоохранения, но и к истинно индивидуализированному подходу, включая питание, физическую активность, назначение лекарств и прочих методов лечения.
Подобную трансформацию медицины следует ожидать в области онкологии, нейронаук и лечения вирусных инфекций, где достижения молекулярной биологии уже наиболее заметны. Считается, что технологии ПМ в этих сферах будут широко применяться к 2025 г. Не только новые таргетные препараты будут создаваться с учетом персонализации, но и применение многих известных молекул и технологий будет уточнено на основании данных геномики и протеомики. Существует мнение, что генотипирование станет «рентгеном 21 века», что основано на представлении о роли генетических тестов в предикции заболеваний, точной диагностике, выборе лечения и прогнозе.
Не все заболевания быстро потребуют персонализированного лечения, эта область будет развиваться постепенно и охватывать новые направления. Но важно осознать, что мы не должны ждать еще десятки лет, чтобы войти в эру персонифицированной медицины, мы должны уже активно внедрять ее принципы в клинические рекомендации и протоколы лечения, в практическую жизнь, что активно происходит во многих системах здравоохранения. Ожидается большой прогресс в биофармацевтическом секторе в этой сфере, что обеспечит генерацию инноваций и новых научных знаний. Для многий стран, таких как США, Япония и Китай, стратегия ПМ стала мейнстримом государственной политики в области здравоохранения, что подробно изложено в настоящем докладе. Крайне важно, что в рамках Национального проекта «Наука» много внимания уделено геномным исследованиям и ПМ. Это станет существенным стимулом к развитию этого направления в РФ.
Переход к ПМ обозначен во всех стратегических документах по науке и инновациям, находится в пике финансирования проектов, включен во все приоритеты и является предметом наиболее активного обсуждения в профессиональном сообществе РФ. Тем не менее остаются нерешенные проблемы, которые Совет РАН обозначает в настоящем докладе и призван отчасти решить в рамках своей деятельности:.
- учреждения и конкретные исследовательские группы, а также подразделения инновационных компаний работают достаточно изолированно;
- отсутствуют общие сервисы, единые стандарты генерации и хранения данных, аналитические подходы и политика использования;
- отсутствует интеграция исследований и единое понимание механизмов трансляции;
- нет конкретных механизмов внедрения технологий ПМ в практику здравоохранения, не предусмотрены системы финансирования таких технологий;
- неготовность профессионального сообщества к внедрению технологий, недостаточная подготовка медицинских работников в области генетики информационных технологий.
Все вышеизложенное легло в основу подготовки Доклада, охватывает как общие, так и частные вопросы ПМ, описывает современное состояние проблемы в мире и перспективы развития на ближайшие годы.
Caulfi eld BM, Donnelly SC. What is Connected Health and why will it change your practice? // QJM. 2013;106:703–707
Offit K. Personalized medicine: new genomics, old lessons // Hum Genet. 2011; 130:3-40
Offit K. Genomic profi les for disease risk: predictive or premature? // JAMA. 2008;299:1353–1355
Sherkow J.S., Greely H.T. The future of gene patents and the implications for medicine // JAMA Intern Med. 2013;173:1569–1570
Offit K. Genomic profi les for disease risk: predictive or premature? // JAMA. 2008;299:1353–1355
Sherkow J.S., Greely H.T. The future of gene patents and the implications for medicine // JAMA Intern Med. 2013;173:1569–1570
Обзор текущей ситуации в отношении развития технологий и рынка в области персонализированной медицины
Обзор крупных проектов по внедрению персонализированной медицины и инфраструктура в различных странах мира
Большинство стран с развитой системой здравоохранения и высокой технологической готовностью к выполнению большого числа генетических тестов в последнее десятилетие активно принимают крупные государственные программы с привлечением частных инвестиций, которые направлены:
Далее опишем наиболее крупные проекты в различных географических регионах, их объем, организационные структуры, сроки выполнения и цели. Более подробная информация о каждом проекте содержится по интернет-ссылкам на сайтах инициатив и учреждений и в опубликованных статьях.
- на рост компетенций и мирового приоритета в области геномных данных;
- формирование биобанков с хранением геномных данных, сопряженных с фенотипированием и другими медицинскими данными;
- формирование специализированных программ по практическом использованию подходов ПМ в онкологии, лечении редких наследственных заболеваний, психиатрии и других сферах.
Далее опишем наиболее крупные проекты в различных географических регионах, их объем, организационные структуры, сроки выполнения и цели. Более подробная информация о каждом проекте содержится по интернет-ссылкам на сайтах инициатив и учреждений и в опубликованных статьях.
Исторически первой страной, которая стала формировать крупные национальные проекты в области геномики и ПМ, стали США, хотя сегодня по объему вложений и скорости развития многие страны начинают опережать США. Тем не менее в 2005 г. Университет Гарварда впервые анонсировал первый Personal Genome Project на 10 000 добровольцев. Это было когортное проспективное исследование, в результате которого в открытом доступе опубликованы деперсонализированные данные полного генома в сочетании с фенотипом – достаточно подробные медицинские данные, включая МРТ.
Эти данные могут использоваться для проверки любых гипотез о связи генотипа и фенотипа, и, как референсные, до сих пор используются многими исследовательским группами. Позднее данный проект был дополнен данным микробиома и сегодня содержит более 50 баз данных по оценке микробиома в различных популяциях пациентов.
Национальный Институт Здоровья США (National Institutes of Health) в 2015 г. сформировал рабочую группу по прецизионной медицине, результатом которой стала большая программа Precision Medicine Initiative, на которую выделено 215 млн дол. США целевым образом из президентского бюджета
Участники проекта:
1. National Institutes of Health (NIH) – формирование когорты.
2. NIH Cancer Institute – онкогеномика.
3. FDA – разработка регуляторных документов для ПМ.
4. Офис Национального координатора по оценке медицинских технологий (ОМТ).
Цель проекта: 1 миллион геномов и продленное наблюдение за участниками. Для этого в Интернете заявлена All of Us Research Program (исследовательская программы «все мы»), в рамках которой каждый человек может стать участником проекта и предоставить свои геномные и медицинские данные.
Программа включает в себя следующие структурные компоненты:
• биобанк;
• дата-центр;
• центр по работе с участниками (волонтерами);
• ряд партнеров по анализу генома;
• по работе с данными медицинских учреждений;
• центр по сбору дистанционных (телемедицинских) данных.
Большинство проектов в США курирует подразделение NIH – Национальный институт изучения генома человека (National Human Genome Research Institute (NHGRI)). Крупный проект был инициирован им совместно с Национальным институтом рака (National Cancer Institute (NCI); как Атлас опухолевых геномов (Cancer Genome Atlas (TCGA), обеспечил молекулярную характеристику более 20 000 первичных опухолей и контрольных групп, 33 типа опухолей. За последние годы проект TCGA сгенерировал более 2,5 петабайт геномных, эпигеномных, транскриптомных и протеомных данных об опухолях. База остается открытой для использования всеми учреждениями.
В США активно функционирует сеть IGNITE (Implementing GeNomics In pracTicE). Данный сетевой ресурс сформирован для внедрения технологий ПМ и первоначально в 2013 г. включал три центра и координационный центр, в дальнейшем в него вошло еще несколько учреждений. Базовые учреждения – Университет Флориды, Университет Дьюка, Университет Индианы. Данный консорциум разработал уже 13 клинических рекомендаций для практики по генной диагностике и применению фармакогенетики.
NIH также были первыми в создании сети так называемых недиагностированных заболеваний (Undiagnosed Diseases Network), что также отражает развитие геномной и ПМ. В эту сеть сегодня входит 12 университетов и крупных стационаров США. Работа этой сети дает впечатляющие результаты: более трети обратившихся пациентов имеют установленный диагноз; более трети проведенных полноэкзомных секвенирований подтверждается диагностикой одного или нескольких заболеваний генетической природы. Эта программа тесно связана с другим научными проектами, в частности с Бимолекулярным атласом человека (Human BioMolecular Atlas Program), который представляет собой атлас тела человека на клеточном уровне в открытой сети Интернет.
Отдельное внимание в США посвящено генетике педиатрических заболеваний. Геномный проект Kids First – это новаторская инициатива, направленная на ускорение понимания педиатрических генетических заболеваний. Уделяя основное внимание редким заболеваниям, проект Kids First Genomic Project собирает и анализирует геномные данные тысяч детей и их семей, предоставляя исследователям и медицинским работникам обширную информацию. Этот амбициозный проект стал жизненно важным ресурсом в области педиатрической геномики, способствуя идентификации новых генетических вариантов и мутаций, вызывающих заболевания. Всесторонне изучая генетический состав больных детей и сравнивая его со здоровыми людьми, ученые могут раскрыть критические данные о механизмах, лежащих в основе этих состояний. Конечная цель состоит в том, чтобы преобразовать эти открытия в улучшенную диагностику, персонализированное лечение и потенциальные лекарства для детей, столкнувшихся с этими сложными заболеваниями.
С момента создания проект Kids First Genomic добился значительных успехов в расширении знаний о детских генетических заболеваниях. Исследователи, врачи и семьи одинаково полагаются на эту бесценную базу данных для совместного изучения и понимания сложного мира детских генетических нарушений. Открытый доступ к проекту способствует обмену данными и развитию духа сотрудничества, способствуя объединению усилий по улучшению жизни детей и их семей, страдающих редкими генетическими заболеваниями.
GnomAD – база данных агрегации геномов, представляет собой всеобъемлющий ресурс, в котором хранятся крупномасштабные геномные данные различных человеческих популяций. Впервые он был запущен в 2016 г. в результате совместных усилий Института Броуда Массачусетского технологического института и Гарварда, а также групп, участвующих в Консорциуме ExAC. Первоначальная версия ExAC была ориентирована в первую очередь на данные секвенирования экзома, собирая генетическую информацию более, чем от 60 000 человек из разных популяций. Основываясь на успехе ExAC, был представлен GnomAD, расширивший сферу своей деятельности за счет включения данных секвенирования как экзома, так и генома из еще более крупных когорт. GnomAD предоставляет обширный каталог генетических вариантов, собранных в ходе проектов по секвенированию экзома и генома, что позволяет исследовать частоту и распространенность этих вариантов в разных этнических группах. Он служит ценным инструментом в изучении генетики человека, помогая в идентификации редких и частых генетических вариаций и способствуя пониманию генетического разнообразия и восприимчивости к болезням. Исследователи и врачи полагаются на GnomAD для принятия клинических решений о патогенности генетических вариаций. В базу данных вносятся постоянные обновления и улучшения, повышающие ее полезность и точность. Открытый подход к доступу к данным способствовал широкому внедрению и внес значительный вклад в развитие геномики и точной медицины.
Эти данные могут использоваться для проверки любых гипотез о связи генотипа и фенотипа, и, как референсные, до сих пор используются многими исследовательским группами. Позднее данный проект был дополнен данным микробиома и сегодня содержит более 50 баз данных по оценке микробиома в различных популяциях пациентов.
Национальный Институт Здоровья США (National Institutes of Health) в 2015 г. сформировал рабочую группу по прецизионной медицине, результатом которой стала большая программа Precision Medicine Initiative, на которую выделено 215 млн дол. США целевым образом из президентского бюджета
Участники проекта:
1. National Institutes of Health (NIH) – формирование когорты.
2. NIH Cancer Institute – онкогеномика.
3. FDA – разработка регуляторных документов для ПМ.
4. Офис Национального координатора по оценке медицинских технологий (ОМТ).
Цель проекта: 1 миллион геномов и продленное наблюдение за участниками. Для этого в Интернете заявлена All of Us Research Program (исследовательская программы «все мы»), в рамках которой каждый человек может стать участником проекта и предоставить свои геномные и медицинские данные.
Программа включает в себя следующие структурные компоненты:
• биобанк;
• дата-центр;
• центр по работе с участниками (волонтерами);
• ряд партнеров по анализу генома;
• по работе с данными медицинских учреждений;
• центр по сбору дистанционных (телемедицинских) данных.
Большинство проектов в США курирует подразделение NIH – Национальный институт изучения генома человека (National Human Genome Research Institute (NHGRI)). Крупный проект был инициирован им совместно с Национальным институтом рака (National Cancer Institute (NCI); как Атлас опухолевых геномов (Cancer Genome Atlas (TCGA), обеспечил молекулярную характеристику более 20 000 первичных опухолей и контрольных групп, 33 типа опухолей. За последние годы проект TCGA сгенерировал более 2,5 петабайт геномных, эпигеномных, транскриптомных и протеомных данных об опухолях. База остается открытой для использования всеми учреждениями.
В США активно функционирует сеть IGNITE (Implementing GeNomics In pracTicE). Данный сетевой ресурс сформирован для внедрения технологий ПМ и первоначально в 2013 г. включал три центра и координационный центр, в дальнейшем в него вошло еще несколько учреждений. Базовые учреждения – Университет Флориды, Университет Дьюка, Университет Индианы. Данный консорциум разработал уже 13 клинических рекомендаций для практики по генной диагностике и применению фармакогенетики.
NIH также были первыми в создании сети так называемых недиагностированных заболеваний (Undiagnosed Diseases Network), что также отражает развитие геномной и ПМ. В эту сеть сегодня входит 12 университетов и крупных стационаров США. Работа этой сети дает впечатляющие результаты: более трети обратившихся пациентов имеют установленный диагноз; более трети проведенных полноэкзомных секвенирований подтверждается диагностикой одного или нескольких заболеваний генетической природы. Эта программа тесно связана с другим научными проектами, в частности с Бимолекулярным атласом человека (Human BioMolecular Atlas Program), который представляет собой атлас тела человека на клеточном уровне в открытой сети Интернет.
Отдельное внимание в США посвящено генетике педиатрических заболеваний. Геномный проект Kids First – это новаторская инициатива, направленная на ускорение понимания педиатрических генетических заболеваний. Уделяя основное внимание редким заболеваниям, проект Kids First Genomic Project собирает и анализирует геномные данные тысяч детей и их семей, предоставляя исследователям и медицинским работникам обширную информацию. Этот амбициозный проект стал жизненно важным ресурсом в области педиатрической геномики, способствуя идентификации новых генетических вариантов и мутаций, вызывающих заболевания. Всесторонне изучая генетический состав больных детей и сравнивая его со здоровыми людьми, ученые могут раскрыть критические данные о механизмах, лежащих в основе этих состояний. Конечная цель состоит в том, чтобы преобразовать эти открытия в улучшенную диагностику, персонализированное лечение и потенциальные лекарства для детей, столкнувшихся с этими сложными заболеваниями.
С момента создания проект Kids First Genomic добился значительных успехов в расширении знаний о детских генетических заболеваниях. Исследователи, врачи и семьи одинаково полагаются на эту бесценную базу данных для совместного изучения и понимания сложного мира детских генетических нарушений. Открытый доступ к проекту способствует обмену данными и развитию духа сотрудничества, способствуя объединению усилий по улучшению жизни детей и их семей, страдающих редкими генетическими заболеваниями.
GnomAD – база данных агрегации геномов, представляет собой всеобъемлющий ресурс, в котором хранятся крупномасштабные геномные данные различных человеческих популяций. Впервые он был запущен в 2016 г. в результате совместных усилий Института Броуда Массачусетского технологического института и Гарварда, а также групп, участвующих в Консорциуме ExAC. Первоначальная версия ExAC была ориентирована в первую очередь на данные секвенирования экзома, собирая генетическую информацию более, чем от 60 000 человек из разных популяций. Основываясь на успехе ExAC, был представлен GnomAD, расширивший сферу своей деятельности за счет включения данных секвенирования как экзома, так и генома из еще более крупных когорт. GnomAD предоставляет обширный каталог генетических вариантов, собранных в ходе проектов по секвенированию экзома и генома, что позволяет исследовать частоту и распространенность этих вариантов в разных этнических группах. Он служит ценным инструментом в изучении генетики человека, помогая в идентификации редких и частых генетических вариаций и способствуя пониманию генетического разнообразия и восприимчивости к болезням. Исследователи и врачи полагаются на GnomAD для принятия клинических решений о патогенности генетических вариаций. В базу данных вносятся постоянные обновления и улучшения, повышающие ее полезность и точность. Открытый подход к доступу к данным способствовал широкому внедрению и внес значительный вклад в развитие геномики и точной медицины.
С 2020 г. Великобритания анонсировала и запустила крупнейший проект в области геномики Genome UK. В настоящее время реализуется его практическая часть с подробным планом внедрения до 2025 г. Данный проект базируется на реализованных проектах UK Biobank и многих других, давно работающих сервисах, которые позволили поставить амбициозные цели.
Стратегия реализации проекта Genome UK прописана на 10 лет вперед и включает программы:
Вторым блоком программы развития ПМ в Великобритании является внедрение технологий в профилактику. В этом разделе прописан тотальный генетический скрининг в ранние периоды жизни, большая программа по скринингу новорожденных, а также решение организационных и этических вопросов генной диагностики и выявления предрасположенности к генетическим заболеваниям.
Третьим разделом программы является поддержка научных исследований.Поставлена цель глобальной поддержки инноваций, запланировано создание лучшего в мире хранилища геномных данных для исследований, а также стандарты обмена, доступа и инструменты контроля за генетической информацией. Эта часть реализуется в Биобанке Великобритании. Обозначены важные принципы ответственного использования данных, открытость и равноправие доступа, а также устранение влияния этнического фактора, свойственного всем базам данных и равный доступ всех пользователей, что ставит задачу не только национальной когорты, но и набор данных со всего мира. Проект нацелен также на взаимодействие в производственным сектором и имеет план сотрудничества с Ассоциацией британской фарминдустрии и Ассоциацией биоиндустрии (Association of the British Pharmaceutical Industry (ABPI)) and Bioindustry Association (BIA)).
UK Biobank – национальный и интернациональный исследовательский ресурс для исследования причин заболеваний. В нем присутствует информация о 500 000 добровольцев 40–69 лет (финансирование MRC и Wellcome Trust), которые были включены в период 2006–2010 гг. Позднее был подключен проект МРТ изображений для 100 000 участников. В 2019 г. инвестировано 200 млн фунтов от Правительства для выполнения секверинрования геномов. Сегодня биобанк востребован 1500 институтами из 68 стран, более 1000 статей.
Программа по ускоренному развитию геномной медицины в Великобритании на 2022–2027 гг. Accelerating genomic medicine in the NHS.
Программа включает приоритетные направления:
Стратегия реализации проекта Genome UK прописана на 10 лет вперед и включает программы:
- практического внедрения технологий персонализированной медицины;
- профилактики заболеваний на основе геномных данных;
- исследовательских проектов, хранилищ и баз данных.
Вторым блоком программы развития ПМ в Великобритании является внедрение технологий в профилактику. В этом разделе прописан тотальный генетический скрининг в ранние периоды жизни, большая программа по скринингу новорожденных, а также решение организационных и этических вопросов генной диагностики и выявления предрасположенности к генетическим заболеваниям.
Третьим разделом программы является поддержка научных исследований.Поставлена цель глобальной поддержки инноваций, запланировано создание лучшего в мире хранилища геномных данных для исследований, а также стандарты обмена, доступа и инструменты контроля за генетической информацией. Эта часть реализуется в Биобанке Великобритании. Обозначены важные принципы ответственного использования данных, открытость и равноправие доступа, а также устранение влияния этнического фактора, свойственного всем базам данных и равный доступ всех пользователей, что ставит задачу не только национальной когорты, но и набор данных со всего мира. Проект нацелен также на взаимодействие в производственным сектором и имеет план сотрудничества с Ассоциацией британской фарминдустрии и Ассоциацией биоиндустрии (Association of the British Pharmaceutical Industry (ABPI)) and Bioindustry Association (BIA)).
UK Biobank – национальный и интернациональный исследовательский ресурс для исследования причин заболеваний. В нем присутствует информация о 500 000 добровольцев 40–69 лет (финансирование MRC и Wellcome Trust), которые были включены в период 2006–2010 гг. Позднее был подключен проект МРТ изображений для 100 000 участников. В 2019 г. инвестировано 200 млн фунтов от Правительства для выполнения секверинрования геномов. Сегодня биобанк востребован 1500 институтами из 68 стран, более 1000 статей.
Программа по ускоренному развитию геномной медицины в Великобритании на 2022–2027 гг. Accelerating genomic medicine in the NHS.
Программа включает приоритетные направления:
- Внедрение геномики в национальную систему здравоохранения NHS через ведущую в мире инновационную модель обслуживания от первичной помощи до специализированной и третичной медицинской помощи.
- Обеспечение доступного геномного тестирования для улучшения результатов при лечении злокачественных, орфанных, наследственных и широко распространенных заболеваний, а также для реализации стратегии прецизионной медицины и уменьшения побочных реакций на лекарственные препараты.
- Презентация геномики на переднем крае цифровой революции, обеспечивая правильную интерпретацию и дополнение геномных данных другими диагностическими и клиническими данными.
- Получение пользы пациентами за счет быстрого внедрения в практику достижений передовой науки, исследований и инноваций в области геномной медицины.
В 2017 г. запущен проект FinnGen – глобальный проект, направленный на улучшение здоровья человека за счет развития генетики. Проект носит не только национальный, но и глобальный характер. Идея состоит в совмещении генетических данных и данных информационной системы здравоохранения. Участники – университеты, больницы, региональные системы здравоохранения, биобанки, бизнес-партнеры и общество.
Финансирование – Business Finland и 13 фармацевтических компаний: Abbvie, AstraZeneca, Biogen, Boehringer Ingelheim, Bristol-Myers Squibb, Genentech, a Member of the Roche Group, GlaxoSmithKline (GSK), Janssen, Maze Therapeutics, MSD (the Tradename of Merck & Co., Inc, Kenilworth, NJ USA), Novartis, Pfizer and Sanofi.
Координация проекта – Университет Хельсинки, координатор сбора образцов Helsinki Biobank.
Клинические экспертные группы:
Финансирование – Business Finland и 13 фармацевтических компаний: Abbvie, AstraZeneca, Biogen, Boehringer Ingelheim, Bristol-Myers Squibb, Genentech, a Member of the Roche Group, GlaxoSmithKline (GSK), Janssen, Maze Therapeutics, MSD (the Tradename of Merck & Co., Inc, Kenilworth, NJ USA), Novartis, Pfizer and Sanofi.
Координация проекта – Университет Хельсинки, координатор сбора образцов Helsinki Biobank.
Клинические экспертные группы:
- онкология;
- неврология;
- кардометаболические заболевания;
- офтальмология;
- респираторная медицина;
- ЛОР;
- депрессии;
- женское здоровье и репродукция;
- одонтология;
- дерматология;
- гастроэнтерология.
Швейцария среди европейских стран активно развивает не только исследования, но и практическое внедрение фармакогеномики и ПМ, в том числе работают коммерческие клиники с анонсированием ПМ. В стране с 2017 г. работает национальная инициатива National Support Initiative ’Personalised Medicine’, которая поддерживается государственным комитетом (секретариатом) по исследованиям, образованию и инновациям (SERI). Инициатива занимается созданием инфраструктуры и единых стандартов для геномных исследований, поддержкой сопутствующих проектов (биобанки, когортные исследования), а также созданием рекомендаций по изменениям в регуляторные документы. Данная инициатива поддерживает взаимодействие национальной академии медицинских наук, научных учреждений и национального фонда науки. Общую координацию проекта осуществляет именно Академия наук, дата-центром стал Швейцарский институт биоинформатики. Швейцарская академия наук создала в 2017 г. SwissPersonalized Health Network (SPHN). Предполагается, что в 2024 г. инициатива будет уже не нужна – дата-центры и инфраструктура будут работать в качестве рутинной практики.
SwissMedic – это независимое федеральное агентство, ответственное за регулирование продуктов, которые подпадают под закон о лекарствах и медицинских изделиях в Швейцарии. В рамках своих обязанностей SwissMedic играет ключевую роль в установлении стандартов безопасности и эффективности лекарственных средств.
В контексте фармакогенетики SwissMedic работает над внедрением фармакогенетических тестов в клиническую практику. Они разрабатывают руководства и предоставляют регуляторные рекомендации по использованию таких тестов, а также регулируют их использование в лечении и превентивной медицине.
Клиники Швейцарии, которые официально предоставляют услуги в области персонализированной медицины и фармакогенетики:
SwissMedic – это независимое федеральное агентство, ответственное за регулирование продуктов, которые подпадают под закон о лекарствах и медицинских изделиях в Швейцарии. В рамках своих обязанностей SwissMedic играет ключевую роль в установлении стандартов безопасности и эффективности лекарственных средств.
В контексте фармакогенетики SwissMedic работает над внедрением фармакогенетических тестов в клиническую практику. Они разрабатывают руководства и предоставляют регуляторные рекомендации по использованию таких тестов, а также регулируют их использование в лечении и превентивной медицине.
Клиники Швейцарии, которые официально предоставляют услуги в области персонализированной медицины и фармакогенетики:
В 2015 г. во Франции принята программа «Персонализированная медицина во Франции-2025» (France Genomic Medicine Plan). С целью реализации создан альянс учреждений, занимающихся геномикой и ПМ. В нем предусмотрено несколько блоков, среди которых ревматология, онкология, питание и метаболизм, геномика и биоинформатика, иммунология, нейронауки и инновации.
Цели программы:
1. Укрепить позицию Франции в области геномной медицины за 10 лет и сформировать научную и производственную базу.
2. Сформировать к 2025 г. возможность равного доступа к геномным технологиям всех жителей Франции, в том числе для больных раком, генетическими заболеваниями и др.
3. Обеспечить к 2025 г. секвенирование 235 000 геномов в год, 60 000 геномов пациентов с редкими заболеваниями и их семей, 50 000 геномов пациентов с рефрактерными и метастатическим формами рака.
Инфраструктура проекта:
Цели программы:
1. Укрепить позицию Франции в области геномной медицины за 10 лет и сформировать научную и производственную базу.
2. Сформировать к 2025 г. возможность равного доступа к геномным технологиям всех жителей Франции, в том числе для больных раком, генетическими заболеваниями и др.
3. Обеспечить к 2025 г. секвенирование 235 000 геномов в год, 60 000 геномов пациентов с редкими заболеваниями и их семей, 50 000 геномов пациентов с рефрактерными и метастатическим формами рака.
Инфраструктура проекта:
- 12 центров секвенирования по стране;
- National Center for Intensive Calculation – центр хранения и анализа данных;
- изменения в законодательстве, регуляторике и оплате МП;
- формирование новой бизнес-модели для геномной медицины;
- модификация образовательных программ в университетах;
- поддержка бизнеса, создание национального центра технологий и инноваций в области ПМ.
Персонализированная медицина в Германии развивается давно и имеет много направлений, среди которых самое сильное – онкология. В 2010 г. основана сеть геномной медицины Network Genomic Medicine, University of Cologne and German Cancer Research Institute (DKFZ) основали специальную сеть по диагностике рака легких, имеют лучшую в мире карту мутаций. Сеть нацелена не только на научные исследования, но и на развитие по всей стране центров компетенций по онкогеномике. Сегодня уже 13 онкологических центров принимает участие в проекте. Среди целей – оценка качества молекулярной диагностики, универсальная документация, клинические исследования по ПМ, вопросы возмещения затрат и др.
Правительство Германии приняло программу genomeDE в рамках National Strategy for Genomic Medicine (Национальная стратегия геномной медицины). Основы стратегии были прописаны в 2019 г. В декабре 2019 г. Министерство здравоохранения Германии выпустило декларацию «Разработка и дизайн национальной платформы для секвенирования генома с целью улучшений здравоохранения граждан». В январе 2020 г. Германия стала одним из 21 европейских членов инициативы «1 миллион геномов». Результатом программы стала разработка Model Project и включение генетических тестов в диагностику опухолей и генетических заболеваний на территории всей страны. Новая модель оказания помощи планируется к старту в 2024 г. GenomeDE финансируется напрямую Министерством здравоохранения Германии – это консорциум организаций из 14 членов, включает ключевую инфраструктуру, сеть банков данных, стандарты технологий секвенирования и обучение медицинских работников.
Правительство Германии приняло программу genomeDE в рамках National Strategy for Genomic Medicine (Национальная стратегия геномной медицины). Основы стратегии были прописаны в 2019 г. В декабре 2019 г. Министерство здравоохранения Германии выпустило декларацию «Разработка и дизайн национальной платформы для секвенирования генома с целью улучшений здравоохранения граждан». В январе 2020 г. Германия стала одним из 21 европейских членов инициативы «1 миллион геномов». Результатом программы стала разработка Model Project и включение генетических тестов в диагностику опухолей и генетических заболеваний на территории всей страны. Новая модель оказания помощи планируется к старту в 2024 г. GenomeDE финансируется напрямую Министерством здравоохранения Германии – это консорциум организаций из 14 членов, включает ключевую инфраструктуру, сеть банков данных, стандарты технологий секвенирования и обучение медицинских работников.
Испанская стратегия развития ПМ до 2027 г. (составная часть Испанской стратегии развития науки, техники и инноваций на 2021–2027 гг.) направлена на исследования в области больших данных, геномики, обучение медицинских работников в области персонализированной медицины.
Испанская программа по недиагностированным РЗ (SpainUDP: The Spanish Undiagnosed Rare Diseases Program) была реализована Институтом исследований редких заболеваний Института здоровья имени Карлоса III, включает биобанк редких заболеваний (BioNER), испанский реестр пациентов с РЗ (SpainRDR) и базу данных мутаций (SpainMDB).
Испанская программа по недиагностированным РЗ (SpainUDP: The Spanish Undiagnosed Rare Diseases Program) была реализована Институтом исследований редких заболеваний Института здоровья имени Карлоса III, включает биобанк редких заболеваний (BioNER), испанский реестр пациентов с РЗ (SpainRDR) и базу данных мутаций (SpainMDB).
В Италии реализован проект BARCODING MS, посвященный регистру и персонализированной терапии рассеянного склероза. В 2022 г. проект получил премию международного консурциума по ПМ за лучшее внедрение персонализированной медицины.
Итальянское общество персонализированной медицины проводит активную образовательную политику в данной области Mario Negri Institute for Pharmacological Research – ключевой исследовательский институт – разработки исследовательских проектов.
Итальянское общество персонализированной медицины проводит активную образовательную политику в данной области Mario Negri Institute for Pharmacological Research – ключевой исследовательский институт – разработки исследовательских проектов.
Развитие ПМ в Китае давно стало одним из национальных приоритетов. В 2016 г. был принят 13-й пятилетний экономический план, и ПМ была включена как одно из генеральных направлений развития. В 2017 г. принят стратегический план «Здоровый Китай 2030». Министерство науки и технологий в 2016 г. объявило ПМ стратегическим направлением научно-технологического развития. За период 2016–2018 гг. инвестировано в 100 проектов 1,3 млрд юаней (примерно 200 млн дол. США). В 2020 г. основан Институт редких заболеваний в госпитале Chengdu (Sichuan) province, к 2025 г. институт планирует создать базу данных 100 000 пациентов с редкими генетическими заболеваниями.
В 2019 г. правительство Китая основало два открытых дата-центра для стимулирования обмена данными – национальный центр генетических данных (National Genomics Data Center) и его дочерняя организация Китайский национальный центр биоинформатики (China National Center for Bioinformation). Эти проекты – часть Пекинского Институт геномики.
Китай активно взаимодействует c Open Biodiversity and Health Big Data Initiative, основанной международным союзом биологических наук (The International Union of Biological Sciences (IUBS)), а также с альянсом международных исследовательских организаций (Alliance of International Science Organizations (ANSO). Ресурс включает почти 40 петабайт хранилищ данных. Базы данных охватывают геномные данные их вариации геномов, эпигенетику, данные экспрессии, омиксные данные отдельных клеток, базу данных некодирующих РНК.
В 2019 г. правительство Китая основало два открытых дата-центра для стимулирования обмена данными – национальный центр генетических данных (National Genomics Data Center) и его дочерняя организация Китайский национальный центр биоинформатики (China National Center for Bioinformation). Эти проекты – часть Пекинского Институт геномики.
Китай активно взаимодействует c Open Biodiversity and Health Big Data Initiative, основанной международным союзом биологических наук (The International Union of Biological Sciences (IUBS)), а также с альянсом международных исследовательских организаций (Alliance of International Science Organizations (ANSO). Ресурс включает почти 40 петабайт хранилищ данных. Базы данных охватывают геномные данные их вариации геномов, эпигенетику, данные экспрессии, омиксные данные отдельных клеток, базу данных некодирующих РНК.
The Singapore National Precision Medicine Strategy – стратегия развития персонализированной медицины, принята в 2017 г.
Программа разделена на три этапа:
Клиническое внедрение:
Программа разделена на три этапа:
- Этап 1. 2017–2021 гг. – 10 000 геном. Проведено секвенирование 10 000 гоном жителей Сингапура и поиск партнеров.
- Этап 2. 2022–2024 гг. – 100 000 геномов. Создание централизованной базы данных, аолногеномный сиквенс 100 000, внедрение генетики в клинику, оценка ценности (экономической эффетивности).
- Этап 3. 2025–2027 гг. – 1 миллион геномов. Формирование популяционной стратегии на основе геномных данных, ответственное широкое внедрение ПМ, экспорт технологий made-in Singapore.
Клиническое внедрение:
- выявление клинически значимых кейсов;
- консультация с мультидисцилнарной командой;
- стандарты тестирования;
- сбор данных и оценка эффективности при моратории на оплату за счет страховки;
- валидация модели и оценка ценности.
Япония, как страна с большими инвестициями в науку, была вовлечена в развитие геномной медицины давно. Она одна из шести стран, которая выполняла проект «геном человека» и отвечала за 11 и 21 хромосому. С 2013 г. Япония начала реализовывать программы развития генетики и ПМ в виде крупных государственных проектов.
В Японии в 2013 г. принята Стратегия 2013 – здоровье и медицина. Genomic Medicine Project.
В стратегии определены цели до 2015 г.:
Среди сформированных биобанков наиболее известны:
Medical Genome Center (Медицинский геномный центр Японии) занимается уже клиническим применением геномных данных, в его структуре вся координация внедрения онкогеномики и профилактической генетики в центрах профилактики.
Япония провозглашает девизом будущего применение геномных данных для всех поколений, что решит проблему старения, роста продолжительности жизни, здорового детства и др. Стратегическая цель в развитии ПМ в Японии – это создание центров обработки больших данных в биомедицине – интеграция между собой омиксных данных и данных медицинский информационных систем, содержащих данные о пациенте и результатах всех видов его обследований.
Примером интеграции медицинского применения является The Institute of Medical Science, TheUniversity of Tokyo (IMSUT), его структура от суперкомпьютера до исследовательского госпиталя. Госпиталь рассчитан на 135 коек и занимается полным циклом генной диагностики. Включает также центр биоинформатики, центр регенеративной медицины и др. Все заинтересованные госпитали Японии объединены в Japanese Association of Hospitals for Genetic Medicine(Ассоциация клиник геномной медицины). Большая роль принадлежит также Японскому обществу генетики.
Обособленная сеть больниц и исследовательских центров создана для онкологии, в 2017 г. Министерство здравоохранения провела встречу Cancer Genomic Medicine Promotion Consortium (EMCGMPC), которая определила две ветви развития онкогеномики в Японии.
В Японии с 2015 г. работает собственная инициатива и проект по редким и недиагностированным заболеваниям The Initiative on Rare and Undiagnosed Disease (IRUD). В рамках этой инициативы работает множество научных и клинических групп, которые делятся данными о генетической патологии, в том числе с международным сообществом. К марту 2020 г. IRUD включает 487 учреждений, 3753 образцов геномной ДНК, 2512 колоний лимфобластных клеток, 5609 родословных – 15608 человек (фенотипы и генетические данные).
Ряд научных проектов возглавляет Национальный институт генетики. В Японии достаточно сильны производители генетического оборудования и реактивов, которые активно участвуют в продвижении идей. Это компания Takara Bio, в том числе производящая препараты для генной терапии, а также Sysmex Corporation.
В Японии в 2013 г. принята Стратегия 2013 – здоровье и медицина. Genomic Medicine Project.
В стратегии определены цели до 2015 г.:
- формирование сети биобанков;
- создание центрального геномного центра и медицинского геномного центра;
- формирование референсной базы для Японии Japanese RefSeq;
- построение связей между генотипом и фенотипом.
- улучшение здоровья и профилактики;
- установление предиктивной диагностики рака;
- старт исследований генетики в области деменции;
- выявление патогенеза неврологических заболеваний и нейродегенерации.
Среди сформированных биобанков наиболее известны:
- BioBank Japan – сформирован в 2003 г., с 2018 г. работает в формате центра коллективного пользования более 50 университетов и исследовательских организаций (200 000 больных с различными заболеваниями, более 50 нозологий);
- National CenterBiobank Network (шесть региональных центров);
- Tohoku Medical Megabank Project – популяционный биобанк на 150 000 участников. Сегодня этот банк включает не только хранение, но и организацию когортных исследований и информатику здоровья. Хранит уже более миллиона образцов сыворотки и более 300 000 ДНК.
Medical Genome Center (Медицинский геномный центр Японии) занимается уже клиническим применением геномных данных, в его структуре вся координация внедрения онкогеномики и профилактической генетики в центрах профилактики.
Япония провозглашает девизом будущего применение геномных данных для всех поколений, что решит проблему старения, роста продолжительности жизни, здорового детства и др. Стратегическая цель в развитии ПМ в Японии – это создание центров обработки больших данных в биомедицине – интеграция между собой омиксных данных и данных медицинский информационных систем, содержащих данные о пациенте и результатах всех видов его обследований.
Примером интеграции медицинского применения является The Institute of Medical Science, TheUniversity of Tokyo (IMSUT), его структура от суперкомпьютера до исследовательского госпиталя. Госпиталь рассчитан на 135 коек и занимается полным циклом генной диагностики. Включает также центр биоинформатики, центр регенеративной медицины и др. Все заинтересованные госпитали Японии объединены в Japanese Association of Hospitals for Genetic Medicine(Ассоциация клиник геномной медицины). Большая роль принадлежит также Японскому обществу генетики.
Обособленная сеть больниц и исследовательских центров создана для онкологии, в 2017 г. Министерство здравоохранения провела встречу Cancer Genomic Medicine Promotion Consortium (EMCGMPC), которая определила две ветви развития онкогеномики в Японии.
- Первая стратегия включала развитие сети больниц, которые обеспечивают генетическое типирование опухолей, экспертные заключения по персонализированному лечению, генетическое консультирование пациентов и осуществление клинических исследований (примерный аналог референсных центров в РФ).
- Второй частью проекта по онкогеномике стало создание дата-центра Center for Cancer Genomics and Advanced Therapeutics (C-CAT), который собирает и хранит как генетическую, так и медицинскую информацию о пациентах, у которых проведено генетическое типирование опухолей. Этот центр агрегирует данные госпиталей и бизнеса. Проект по онкогеномике стартовал в 2019 г. и уже включает более 150 больниц в свою сеть, а C-CAT собрал геномные данные от более чем 40 тыс. пациентов.
В Японии с 2015 г. работает собственная инициатива и проект по редким и недиагностированным заболеваниям The Initiative on Rare and Undiagnosed Disease (IRUD). В рамках этой инициативы работает множество научных и клинических групп, которые делятся данными о генетической патологии, в том числе с международным сообществом. К марту 2020 г. IRUD включает 487 учреждений, 3753 образцов геномной ДНК, 2512 колоний лимфобластных клеток, 5609 родословных – 15608 человек (фенотипы и генетические данные).
Ряд научных проектов возглавляет Национальный институт генетики. В Японии достаточно сильны производители генетического оборудования и реактивов, которые активно участвуют в продвижении идей. Это компания Takara Bio, в том числе производящая препараты для генной терапии, а также Sysmex Corporation.
В Бразилии за последние годы принят ряд национальных программ в области генетики и ПМ. Также страна является активным членом ряда международных консорциумов.
Бразильская инициатива Прецизионной медицины (Brazilian Initiative on Precision Medicine) разработана пятью научными центрами: Brazilian Research Institute for Neuroscience and Neurotechnology; Centre for Computational Science and Engineering; Centre for Research in Cell Therapy; Centre for Research on Inflammatory Diseases; Obesity and Comorbidities Research Centre.
Инициатива поддержана Sao Paulo Research Foundation (FAPESP), работает на своей платформе, но основана на принципах Global Alliance for Genomics and Health. Это первая геномная платформа для Латинской Америки, которая дает публичный доступ к геномным и фенотипическим данным.
Brazil’s DNA project (Бразильский ДНК проект) – вторая инициатива, которая реализуется Университетом Сан-Паоло в сотрудничестве с компанией Dasa и GoogleCloud. Аналогично всем подобным проектам эта инициатива предполагает создание открытого доступа к геномам жителей Бразилии и их молекулярным отпечаткам. Проект включает 15 разных регионов Бразилии, участников от 35 до 74 лет, участников LongitudinalAdult Health Study (ELSA), самого крупного эпидемиологического проекта Бразилии, поддерживаемого Министерством здравоохранения.
Практическому внедрению ПМ в Бразилии, как и в других странах, препятствует регуляторика в системе здравоохранения. В связи с этим постоянно реформируются и формироуются новые законы и правила, в том числе для клеточной терапии, генной терапии и других высокотехнологичных продуктов.
Бразильская инициатива Прецизионной медицины (Brazilian Initiative on Precision Medicine) разработана пятью научными центрами: Brazilian Research Institute for Neuroscience and Neurotechnology; Centre for Computational Science and Engineering; Centre for Research in Cell Therapy; Centre for Research on Inflammatory Diseases; Obesity and Comorbidities Research Centre.
Инициатива поддержана Sao Paulo Research Foundation (FAPESP), работает на своей платформе, но основана на принципах Global Alliance for Genomics and Health. Это первая геномная платформа для Латинской Америки, которая дает публичный доступ к геномным и фенотипическим данным.
Brazil’s DNA project (Бразильский ДНК проект) – вторая инициатива, которая реализуется Университетом Сан-Паоло в сотрудничестве с компанией Dasa и GoogleCloud. Аналогично всем подобным проектам эта инициатива предполагает создание открытого доступа к геномам жителей Бразилии и их молекулярным отпечаткам. Проект включает 15 разных регионов Бразилии, участников от 35 до 74 лет, участников LongitudinalAdult Health Study (ELSA), самого крупного эпидемиологического проекта Бразилии, поддерживаемого Министерством здравоохранения.
Практическому внедрению ПМ в Бразилии, как и в других странах, препятствует регуляторика в системе здравоохранения. В связи с этим постоянно реформируются и формироуются новые законы и правила, в том числе для клеточной терапии, генной терапии и других высокотехнологичных продуктов.
Австралия одна из передовых стран по развитию генетических технологий и практическому внедрению ПМ.
В 2020 г. АМА (Австралийская медицинская ассоциация) опубликовала программную статью о роли персонализированной и геномной медицины и стратегии ее внедрения. В Австралии большинство проектов инициируется и поддерживается National Health and Medical Research Council (NHMRC).
Наиболее крупный проект это Australian Genomics, который запущен в 2016 г. и нацелен на внедрение достижений генетики в практику здравоохранения и развитие технологий персонализированной медицины, финансируется NHMRC.
Zero Childhood Cancer Program – специальная программа, посвященная детским опухолям и прецизионной медицине. В программу включено более 1000 детей с опухолями по всему континенту. К концу 2023 г. должны быть охвачены все дети Австралии, имеющие данный диагноз. Цель состоит в том, что каждый ребенок будет иметь доступ к персонализированному лечению. 400 пациентов включено с раком высокого риска и низкой ожидаемой продолжительностью жизни. Программа открытая имеет 19 сотрудничающих центров в Австралии и других станах. С исследовательской целью можно получать доступ к данным, в том числе к ксенографтам опухолей и РНК.
Большое внимание персонализированному подходу уделяется в Австралийском плане лечения рака на период 2022–2030 гг.
Ассоциация генетической поддержки Австралии The Association of Genetic Support of Australasia (AGSA1) основана еще в 1998 г. и занимается редкими заболеваниями. Министерство здравоохранения и старения (FederalMinister for Health and Ageing) планирует национальный проект по редким заболеваниям National Plan for RareDiseases, Therapeutic Goods Administration (TGA) – австралийский эквивалент FDA, утверждает перечень лекарственного обеспечения для редких заболеваний. Активную роль играет пациентская организация Rare Voices Australia (RVA).
Genetic Alliance Australia осуществляет исследовательские и популярные проекты в Австралии по редким генетическим заболеваниям.
Australian Genomics Health Alliance является частью Global Genomics Medical Consortium и курирует более 80 проектов. Исследовательская часть локализуется в The Centre for Genetic Origins of Health and Disease (GOHaD). Центр объединяет несколько организаций и занимается в основном полигенными рисками и генетикой распространенных заболеваний.
Общество генетики человека (Human Genetics Society of Australasia) было основано еще в 1977 г. Проекты по генетике местных аборигенов существенно обогатили современные знания о миграции и происхождении многих популяций.
Национальный совет по здоровью и медицинской науке (The National Health and Medical Research Council(NHMRC)) обеспечивает немало ресурсов для исследований и практического здравоохранения, а также представил дорожную карту по интеграции генетики в практику медицины Австралии. 99 % неврожденных вовлечены в генетический неонатальный скрининг по 25 нозологиям, в настоящее время имеется 220 кандидатов для таких тестов. В апреле 2022 г. Австралия стала второй страной после Великобритании, разрешающей рождение детей от родителей при митохнодриальных заболеваниях.
The National Centre for Indigenous Genomics (NCIG) (Национальный центр геномики коренных жителей) основан на базе Австралийского национального университета, коллекционирует образцы геномов коренных жителей Австралии.
Mackenzie’s Mission: The Australian Reproductive Carrier Screening Project (проект скрининга врепродуктивной медицине). Проект предполагает предоставление возможности генетического консультирования и пренатального скрининга для семей с высоким риском рождения детей с генетической патологией.
National Kidney Genomics Program – национальная программа генома при патологии почек. Предполагает идентификацию генетических причин почечных заболеваний, включая моногенные болезни.
В 2020 г. АМА (Австралийская медицинская ассоциация) опубликовала программную статью о роли персонализированной и геномной медицины и стратегии ее внедрения. В Австралии большинство проектов инициируется и поддерживается National Health and Medical Research Council (NHMRC).
Наиболее крупный проект это Australian Genomics, который запущен в 2016 г. и нацелен на внедрение достижений генетики в практику здравоохранения и развитие технологий персонализированной медицины, финансируется NHMRC.
Zero Childhood Cancer Program – специальная программа, посвященная детским опухолям и прецизионной медицине. В программу включено более 1000 детей с опухолями по всему континенту. К концу 2023 г. должны быть охвачены все дети Австралии, имеющие данный диагноз. Цель состоит в том, что каждый ребенок будет иметь доступ к персонализированному лечению. 400 пациентов включено с раком высокого риска и низкой ожидаемой продолжительностью жизни. Программа открытая имеет 19 сотрудничающих центров в Австралии и других станах. С исследовательской целью можно получать доступ к данным, в том числе к ксенографтам опухолей и РНК.
Большое внимание персонализированному подходу уделяется в Австралийском плане лечения рака на период 2022–2030 гг.
Ассоциация генетической поддержки Австралии The Association of Genetic Support of Australasia (AGSA1) основана еще в 1998 г. и занимается редкими заболеваниями. Министерство здравоохранения и старения (FederalMinister for Health and Ageing) планирует национальный проект по редким заболеваниям National Plan for RareDiseases, Therapeutic Goods Administration (TGA) – австралийский эквивалент FDA, утверждает перечень лекарственного обеспечения для редких заболеваний. Активную роль играет пациентская организация Rare Voices Australia (RVA).
Genetic Alliance Australia осуществляет исследовательские и популярные проекты в Австралии по редким генетическим заболеваниям.
Australian Genomics Health Alliance является частью Global Genomics Medical Consortium и курирует более 80 проектов. Исследовательская часть локализуется в The Centre for Genetic Origins of Health and Disease (GOHaD). Центр объединяет несколько организаций и занимается в основном полигенными рисками и генетикой распространенных заболеваний.
Общество генетики человека (Human Genetics Society of Australasia) было основано еще в 1977 г. Проекты по генетике местных аборигенов существенно обогатили современные знания о миграции и происхождении многих популяций.
Национальный совет по здоровью и медицинской науке (The National Health and Medical Research Council(NHMRC)) обеспечивает немало ресурсов для исследований и практического здравоохранения, а также представил дорожную карту по интеграции генетики в практику медицины Австралии. 99 % неврожденных вовлечены в генетический неонатальный скрининг по 25 нозологиям, в настоящее время имеется 220 кандидатов для таких тестов. В апреле 2022 г. Австралия стала второй страной после Великобритании, разрешающей рождение детей от родителей при митохнодриальных заболеваниях.
The National Centre for Indigenous Genomics (NCIG) (Национальный центр геномики коренных жителей) основан на базе Австралийского национального университета, коллекционирует образцы геномов коренных жителей Австралии.
Mackenzie’s Mission: The Australian Reproductive Carrier Screening Project (проект скрининга врепродуктивной медицине). Проект предполагает предоставление возможности генетического консультирования и пренатального скрининга для семей с высоким риском рождения детей с генетической патологией.
National Kidney Genomics Program – национальная программа генома при патологии почек. Предполагает идентификацию генетических причин почечных заболеваний, включая моногенные болезни.
Right Drug, Right Dose, Right Time – Towards Personalized Medicine (RNPGx) – это канадский национальный консорциум, который объединяет исследователей из различных областей для продвижения персонализированной медицины. RNPGx ставит своей целью разработку и внедрение инструментов и методов, которые помогают в определении оптимального лекарства, дозировки и времени приема для каждого конкретного пациента.
В контексте фармакогенетики, RNPGx активно работает над ускорением внедрения фармакогенетических тестов и рекомендаций в клиническую практику. Они сотрудничают с различными организациями, включая государственные учреждения и академические институты, чтобы обеспечить интеграцию фармакогенетических данных в медицинские решения и улучшить результаты лечения для пациентов.
В контексте фармакогенетики, RNPGx активно работает над ускорением внедрения фармакогенетических тестов и рекомендаций в клиническую практику. Они сотрудничают с различными организациями, включая государственные учреждения и академические институты, чтобы обеспечить интеграцию фармакогенетических данных в медицинские решения и улучшить результаты лечения для пациентов.
Международные консорциумы и базы данных
The International Genome Sample Resource. Результат проекта – 1000 геномов.
EURORDIS – European Organisation for Rare Disorders (Европейская Организация по редким заболеваниям). Включает 74 страны (в том числе РФ, Китай и др.) и более 6000 редких заболеваний. Координация исследований и регистров по редким патологиям, помощь пациентам.
European '1+ Million Genomes' Initiative. Члены консорциума: Франция, Бельгия, Латвия, Испания, Нидерланды. Эстония, Швеция, Норвегия, Словения, Венгрия, Люксембург, Италия, Португалия, Финляндия, Чехия, Германия, Австрия, Великобритания, Мальта, Литва, Хорватия, Кипр, Дания, Греция.
Частью этого проекта является дополнение The Beyond 1 Million Genomes (B1MG), который нацелен на то, чтобы объединить все геномные данные стран Европы. Это позволяет достичь целей и собрать данные об 1 млн европейских геномов. Геномные данные объединяются с фенотипом, но фенотипическое профилирование не очень глубокое – демография, антропометрия и доступ к медицинским данным. Широкий доступ к данным для всех участников позволяет получить больше информации о редких заболеваниях и генетических рисках, что в итоге будет способствовать развитию ПМ. Предполагается, что создание такой базы и доступ к ней будет способствовать развитию инноваций, бизнеса, технологий для ПМ.
European Alliance for Personalized Medicine EAPM. Проект запущен в 2012 г. для улучшения медицинской помощи путем ускорения разработки и внедрения персонализированного лечения и ранней диагностики заболеваний. За время своей работы опубликовано множество публичных материалов и интервью, разработаны и предложены новые проекты, в том числе по Big Data, оценке технологий здравоохранения, методологии клинических исследований и др. Проводит регулярные мероприятия, круглые столы, рабочие группы.
В настоящее время активны два крупных проекта:
Can.Heal.
Консорциум обозначает, что профилактика, диагностика и лечение должны основываться на принципах максимальной выгоды для пациента и в целом общества. Нацелен на использование данных секвенирования нового поколения для персонализации лечения конкретного пациента, в большей степени с раком.
В данном проекте также сосредоточены инструменты построения полигенных рисков, системы биобанков Европы, поддержка принятия решений на основе геномных данных, дистанционное генетическое консультирование, в том числе семейные формы рака. Собирает информацию о новых методах диагностики, интеграции и интерпретации данных, применения NGS и жидкостной биопсии в клинической практике.
Cancer Care Beacon:
International Consortium of Personalized Medicine. Сформирован в 2016 г. Финансирование 2 млн евро из бюджета Евросоюза, в 2021 г. продлен еще на четыре года с еще 2 млн евро финансирования.
Основные направления исследований:
Поскольку это инициатива Евросоюза, то большинство членов из Европы, но активно приглашаются к сотрудничеству и другие участники. Наиболее крупные: Австрия (в лице Министерства науки), Бельгия, Бразилия, Канада, Чехия, Хорватия, Кипр, Фракция, германии (Министерство науки и Министерство здравоохранения), Израиль, Венгрия, Эстония, Финляндия, Италия, Литва, Люксембург, Нидерланды, Ирландия, Норвегия, Польша, Португалия, Словения, Южная Африка, Швеция, Швейцария, Турция, Испания, Румыния, Молдавия.
Ресурс публикует ежегодные отчеты, стратегическое видение развития ПМ в Европе и в мире, проводит регулярные семинары и встречи, публикует большое количество образовательного контента.
В последнее время активное развитие получил расширенный проект интеграции Китая в Международный консорциум по персонализированной медицине (IC2PerMed), который направлен на поддержку сотрудничества между ЕС и Китаем в области исследований, инноваций и политики в ПМ в рамках инициативы ICPerMed.
Undiagnosed Diseases Network International (DNWG-UDNI) – сеть Недиагностированных и редких заболеваний. Основана в 2015 г. по инициативе аналогичной в США при поддержке NIH, а также при участии Wilhelm Foundation (Швеция).
В настоящее время в UDNI участвует 41 страна: Аргентина, Австралия, Австрия, Бельгия, Бразилия, Болгария, Канада, Чили, Китай, Эквадор, Франция, Грузия, Германия, Гану, Гонконг, Венгрия, Индия, Израиль, Италия, Япония, Корея, Кувейт, Мали, Мальта, Мексика, Новая Зеландия, Пакистан, Филиппины, Саудовская Аравия, Сербия, Сингапур, Южная Африка, Южная Корея, Испания, Шри-Ланка, Швеция, Швейцария, Таиланд, Нидерланды, Турция и США).
Международная сеть тесно сотрудничает с Международным консорциумом по исследованию РЗ основанным в 2011 г. (IRDiRC). Одной из основных и амбициозных целей Международного консорциума на 2017–2027 гг. является постановка окончательного диагноза РНЗ в течение одного года с момента выявления.
The Global Genomic Medicine Consortium (G2MC) нацелен на создание сообщества лидеров в области внедрения достижений генетики в клиническую практику. Первоначально был подержан NIH. Сегодня это некоммерческая независимая организация, занимающаяся развитием инструментов внедрения геномной и персонализированной медицины. В мае 2022 г. опубилкван стратегический план на пять лет, включая миссию и видение консорциума.
Консорциум является преемником Global Genomic Medicine Collaborative (GGMC).
Члены консорциума:
The Genomic Medicine Alliance – академическая сеть, объединяющая исследователей, регуляторов и общество, заинтересованных в развитии ПМ. Основан в 2012 г. и включает более 70 стран, в том числе разведывающиеся страны и страны с низким уровнем дохода из Среднего Востока, Азии и Латинской Америки.
The Golden Helix Foundation – международная некоммерческая организация (регистрация в Лондоне), спонсирующая развитие геномной медицины и ее внедрение. Фонд работал в сотрудничестве с Genomic Medicine Alliance, проводя большое число мероприятий, в том числе образовательных (Golden Helix Symposia, Golden Helix Pharmacogenomics Days and Golden Helix Summer Schools. С 2018 г. новостей не публикует и мероприятий не анонсирует.
PharmGKB – база знаний о фармакогеномике. Это мощный ресурс, разработанный и поддерживаемый университетом Stanford, который собирает, курирует и распространяет информацию о влиянии генома человека, на его реакцию на лекарства. Структура базы знаний представляет собой централизованное хранилище, которое включает информацию о генах, лекарствах, вариантах генов и их влиянии на реакцию на лекарственные средства, а также общие концепции фармакогеномики (по состоянию на июль 2023 г. более 200 гайдлайнов фармакогенетических консорциумов и регуляторов FDA и EMA, более 760 лекарств, для которых представлены данные публикаций разного уровня доказательства).
PharmGKB начала свою работу в 2000 г. и с тех пор сыграла важную роль в развитии фармакогеномики и персонализированной медицины. База знаний включает в себя широкий спектр данных, в том числе зарегистрированные ассоциации между вариантами генов и ответом на лекарства, аннотации к генам, влияющим на фармакокинетику и фармакодинамику, а также клинические руководства и диаграммы дозировки для различных лекарств.
PharmGKB активно участвует в разработке и распространении клинических руководств в области фармакогенетики. В частности, они работают в тесном сотрудничестве с CPIC и другими организациями, чтобы сформулировать и распространить руководства по использованию результатов фармакогенетического тестирования в клинической практике.
Также PharmGKB обеспечивает доступ к ценной информации для исследователей, включая структурированные знания о взаимодействиях генов и лекарств и данные об ассоциациях, полученные из многочисленных исследований.
Работа PharmGKB сделала значительный вклад в современное понимание взаимодействия генов и лекарств, и они продолжают играть важную роль в продвижении ПМ. Одним из подразделений является DutchPharmacogenetics Working Group (DPWG). Нидерландская рабочая группа по фармакогенетике создана в 2005 г. Работа этой группы сосредоточена на разработке и опубликовании руководств по фармакогенетике, которые используются во всем мире. DPWG состоит из медицинских специалистов и фармакологов, которые вместе работают над созданием универсальных рекомендаций по применению генетической информации в клинической практике.
DPWG известна своей систематической методологией по определению клинического значения фармакогенетической информации и созданию руководств для применения такой информации в клинической практике. Данный консорциум уже разработал более 70 руководств, охватывающих различные гены и лекарства. В руководствах, среди прочего, указывается, какие изменения в дозировке или выборе лекарства могут потребоваться в зависимости от генотипа пациента.
Clinical Pharmacogenetics Implementation Consortium (CPIC) – это ведущий международный консорциум, который создан для облегчения применения фармакогенетических знаний в клинической практике. CPIC был основан в 2009 г. и включает в себя многие ведущие учебные и исследовательские учреждения по всему миру.
Основная задача CPIC – это создание клинических руководств, которые помогают врачам понять, как использовать результаты фармакогенетических тестов для оптимизации лекарственной терапии. Ключевая особенность этих руководств заключается в том, что они направлены не на то, чтобы решить, следует ли проводить фармакогенетическое тестирование, а на то, как интерпретировать имеющиеся результаты тестирования для конкретного пациента.
CPIC разработал и опубликовал множество руководств для различных генов и препаратов, включая антидепрессанты, статины, антикоагулянты и др. Эти руководства основаны на тщательном анализе имеющихся научных данных и обзоре литературы, включают рекомендации по выбору препарата и дозировки в зависимости от генотипа пациента.
Nordic Society of Human Genetics and Precision Medicine – общество создано для координации деятельности скандинавских стран по трансляции в реальную клиническую практику результатов геномных исследований и их использования в рамках внедрения прецизионной медицины для улучшения показателей здоровья населения.
Европейское партнерство по ПМ как часть программы Горизонт 2023. Проект нацелен на поддержку мероприятий, направленных на «обеспечение доступа к инновационному, устойчивому и высококачественному здравоохранению» в странах ЕС.
Одним из основных направлений реализации программы на 2023/24 гг. является ускорение развития персонализированной медицины в ЕС и ассоциированных странах, в том числе посредством государственно-государственного партнерства в области ПМ. Партнерство открыто для всех государств-членов ЕС, а также для стран, связанных с Horizon Europe, и останется открытым для третьих стран, желающих присоединиться. Партнерство базируется на достижениях других ассоциаций инициатив, в том числе 1 млн геномов.
Консорциум PERMIT – консорциум экспертов в области проведения исследований, особенно клинических, для персонализированной медицины. Включает в себя общеевропейскую исследовательскую инфраструктуру (ECRIN, EATRIS, ELIXIR-LU/UNILU), представительство пациентов, фонды, организации, занимающейся оценкой медицинских технологий (ISCIII и KCE), экспертов по защите данных и регуляторике экспертов в науке (MarioNegri Institute (Италия), Université Paris Descartes, Parc Sanitari Sant Joan de Déu (Франция).
Европейский регистр Orphanet. На сегодня зарегистрирована информация о 6172 уникальных РЗ, 71,9 % из которых являются генетическими и 69,9 % из них имеют дебют исключительно в детском возрасте. На основании анализа регистра получены фактические данные о распространенности РЗ в популяции, которая составляет 3,5–5,9 %, что соответствует 263–446 млн человек по всему миру. Принимая во внимание, что в данном анализе не учитывались редкие виды рака и инфекционных заболеваний, число людей, страдающих от РЗ, скорее всего, значительно выше.
Online Mendelian Inheritance in Man (OMIM). По состоянию на август 2020 г. зарегистрировано 9173 наследственных заболеваний, из которых 3308 относятся к заболеваниям, классифицируемым как фенотипы с неизвестной молекулярной основой.
За последнее десятилетие разработано большое количество веб-платформ и баз данных для обмена данными, которые связаны друг с другом через сеть MatchMaker Exchange (MME), для облегчения сопоставления генов-кандидатов. Благодаря этой платформе открыты сотни новых генов. Другие известные веб-платформы: Code for OMIM analysis and figures, Mouse Genome Database, MyGene2, OnlineMendelian Inheritance in Man, PhenoDB, VariantMatcher. Все позволяют пользователям, не знакомым с биоинформатикой, собирать, хранить, анализировать и обмениваться фенотипическими и геномными данными.
LOVD – одна из старейших европейских баз данных, основанная на базе Лейденского Университета в Нидерландах и предназначенная для сбора и отображения вариантов в последовательности ДНК. Изначально она была ориентирована на варианты в генах, ассоциированных с неврологическими и нейромышечными заболеваниями, но сейчас содержит информацию о большинстве генов, ассоциированных с наследственными заболеваниями человека, и, что наиболее ценно, – содержит минимально необходимую информацию о корреляции генотипов и фенотипов, поскольку основной задачей данного ресурса является соотношение между геном и заболеванием. Расширенная клиническая информация из данной базы доступна только для зарегистрированных пользователей.
Ресурс LOVD активно используется врачами-специалистами (клиническими генетиками) для диагностики и консультирования пациентов с генетическими заболеваниями. В настоящее время ресурс LOVDсодержат информацию о более чем более 515 500 генетических вариантов, из которых 124 000 являются уникальными и редкими и касаются более 5000 генов и более 160 000 пациентов.
Human Genome Mutation Database (HGMD). На момент 2017 г. база данных содержала более 203 000 различных генетических вариантов в основном ядерных (не митохондриальных генов), которые вручную были выбраны из научных публикаций и открытых ресурсов. Сегодня база является центральным объединением и хранилище наследственных мутаций, описанных во всем мире исследователями, клиницистами, диагностическими лабораториями и консультантами-генетиками. важный инструмент для аннотирования данных секвенирования следующего поколения.
Общедоступная версия HGMD находится в свободном доступе для зарегистрированных пользователей из академических учреждений и некоммерческих организаций, но полная версия базы доступна только по подписке (HGMD Professional) для академических, клинических и коммерческих пользователей, что является существенным минусом и затрудняет ее использование.
ClinVar – это общедоступный архив отчетов о взаимосвязи между вариантами в геноме человека (точечными, генными, геномными, хромосомными) и фенотипами. Ресурс размещен Национальным центром биотехнологической информации (NCBI) и финансируется за счет Национального института здравоохранения (NIH) США. Для увеличения информативности ресурса ClinVar со временем проект был расширен и привел к созданию научного проекта ClinGen, целью которого является повышение информативности, функциональности и достоверности информации, выкладываемой в ClinVar, а также для поддержки депонирования данных из многих источников. По сути в рамках проекта ClinGen происходит курация данных, свободно выкладываемых в ClinVar, что должно привести к повышению достоверности информации.
PGC – крупнейший консорциум по психиатрической генетике.
SCHEMA – результаты крупнейшего исследования генетики шизофрении.
EURORDIS – European Organisation for Rare Disorders (Европейская Организация по редким заболеваниям). Включает 74 страны (в том числе РФ, Китай и др.) и более 6000 редких заболеваний. Координация исследований и регистров по редким патологиям, помощь пациентам.
European '1+ Million Genomes' Initiative. Члены консорциума: Франция, Бельгия, Латвия, Испания, Нидерланды. Эстония, Швеция, Норвегия, Словения, Венгрия, Люксембург, Италия, Португалия, Финляндия, Чехия, Германия, Австрия, Великобритания, Мальта, Литва, Хорватия, Кипр, Дания, Греция.
Частью этого проекта является дополнение The Beyond 1 Million Genomes (B1MG), который нацелен на то, чтобы объединить все геномные данные стран Европы. Это позволяет достичь целей и собрать данные об 1 млн европейских геномов. Геномные данные объединяются с фенотипом, но фенотипическое профилирование не очень глубокое – демография, антропометрия и доступ к медицинским данным. Широкий доступ к данным для всех участников позволяет получить больше информации о редких заболеваниях и генетических рисках, что в итоге будет способствовать развитию ПМ. Предполагается, что создание такой базы и доступ к ней будет способствовать развитию инноваций, бизнеса, технологий для ПМ.
European Alliance for Personalized Medicine EAPM. Проект запущен в 2012 г. для улучшения медицинской помощи путем ускорения разработки и внедрения персонализированного лечения и ранней диагностики заболеваний. За время своей работы опубликовано множество публичных материалов и интервью, разработаны и предложены новые проекты, в том числе по Big Data, оценке технологий здравоохранения, методологии клинических исследований и др. Проводит регулярные мероприятия, круглые столы, рабочие группы.
В настоящее время активны два крупных проекта:
Can.Heal.
Консорциум обозначает, что профилактика, диагностика и лечение должны основываться на принципах максимальной выгоды для пациента и в целом общества. Нацелен на использование данных секвенирования нового поколения для персонализации лечения конкретного пациента, в большей степени с раком.
В данном проекте также сосредоточены инструменты построения полигенных рисков, системы биобанков Европы, поддержка принятия решений на основе геномных данных, дистанционное генетическое консультирование, в том числе семейные формы рака. Собирает информацию о новых методах диагностики, интеграции и интерпретации данных, применения NGS и жидкостной биопсии в клинической практике.
Cancer Care Beacon:
- устранение различий в помощи между европейскими странами;
- картирование компетенций и возможностей раковых центров Европы;
- СППР, чтобы помочь пациентам в поиске лучше клиники с необходимыми компетенциями, обеспечение общности данных и подходов;
- обучение и аккредитация по принципам лучшей помощи при опухолях.
International Consortium of Personalized Medicine. Сформирован в 2016 г. Финансирование 2 млн евро из бюджета Евросоюза, в 2021 г. продлен еще на четыре года с еще 2 млн евро финансирования.
Основные направления исследований:
- данные большого объема «-omics»;
- развитие технологий;
- статистика и боинформатика;
- диагностика;
- биомаркеры;
- методология КИ;
- доклинические исследования;
- редкие заболевания;
- пилотные проекты ПМ в здравоохранении;
Поскольку это инициатива Евросоюза, то большинство членов из Европы, но активно приглашаются к сотрудничеству и другие участники. Наиболее крупные: Австрия (в лице Министерства науки), Бельгия, Бразилия, Канада, Чехия, Хорватия, Кипр, Фракция, германии (Министерство науки и Министерство здравоохранения), Израиль, Венгрия, Эстония, Финляндия, Италия, Литва, Люксембург, Нидерланды, Ирландия, Норвегия, Польша, Португалия, Словения, Южная Африка, Швеция, Швейцария, Турция, Испания, Румыния, Молдавия.
Ресурс публикует ежегодные отчеты, стратегическое видение развития ПМ в Европе и в мире, проводит регулярные семинары и встречи, публикует большое количество образовательного контента.
В последнее время активное развитие получил расширенный проект интеграции Китая в Международный консорциум по персонализированной медицине (IC2PerMed), который направлен на поддержку сотрудничества между ЕС и Китаем в области исследований, инноваций и политики в ПМ в рамках инициативы ICPerMed.
Undiagnosed Diseases Network International (DNWG-UDNI) – сеть Недиагностированных и редких заболеваний. Основана в 2015 г. по инициативе аналогичной в США при поддержке NIH, а также при участии Wilhelm Foundation (Швеция).
В настоящее время в UDNI участвует 41 страна: Аргентина, Австралия, Австрия, Бельгия, Бразилия, Болгария, Канада, Чили, Китай, Эквадор, Франция, Грузия, Германия, Гану, Гонконг, Венгрия, Индия, Израиль, Италия, Япония, Корея, Кувейт, Мали, Мальта, Мексика, Новая Зеландия, Пакистан, Филиппины, Саудовская Аравия, Сербия, Сингапур, Южная Африка, Южная Корея, Испания, Шри-Ланка, Швеция, Швейцария, Таиланд, Нидерланды, Турция и США).
Международная сеть тесно сотрудничает с Международным консорциумом по исследованию РЗ основанным в 2011 г. (IRDiRC). Одной из основных и амбициозных целей Международного консорциума на 2017–2027 гг. является постановка окончательного диагноза РНЗ в течение одного года с момента выявления.
The Global Genomic Medicine Consortium (G2MC) нацелен на создание сообщества лидеров в области внедрения достижений генетики в клиническую практику. Первоначально был подержан NIH. Сегодня это некоммерческая независимая организация, занимающаяся развитием инструментов внедрения геномной и персонализированной медицины. В мае 2022 г. опубилкван стратегический план на пять лет, включая миссию и видение консорциума.
Консорциум является преемником Global Genomic Medicine Collaborative (GGMC).
Члены консорциума:
- Америка: Бразилия, Чили, Колумбия, Мексика, Перу, США.
- Европа: Греция, Чехия, Испания.
- Африка: Конго, Египет, Иордания, Мали, Нигерия, ЮАР, Судан, Зимбабве.
- Восток: Кувейт, Катар, ОАЭ.
- Азия: Китай, Малайзия, Непал, Сингапур, Филиппины, Шри-Ланка.
- Австралия.
The Genomic Medicine Alliance – академическая сеть, объединяющая исследователей, регуляторов и общество, заинтересованных в развитии ПМ. Основан в 2012 г. и включает более 70 стран, в том числе разведывающиеся страны и страны с низким уровнем дохода из Среднего Востока, Азии и Латинской Америки.
The Golden Helix Foundation – международная некоммерческая организация (регистрация в Лондоне), спонсирующая развитие геномной медицины и ее внедрение. Фонд работал в сотрудничестве с Genomic Medicine Alliance, проводя большое число мероприятий, в том числе образовательных (Golden Helix Symposia, Golden Helix Pharmacogenomics Days and Golden Helix Summer Schools. С 2018 г. новостей не публикует и мероприятий не анонсирует.
PharmGKB – база знаний о фармакогеномике. Это мощный ресурс, разработанный и поддерживаемый университетом Stanford, который собирает, курирует и распространяет информацию о влиянии генома человека, на его реакцию на лекарства. Структура базы знаний представляет собой централизованное хранилище, которое включает информацию о генах, лекарствах, вариантах генов и их влиянии на реакцию на лекарственные средства, а также общие концепции фармакогеномики (по состоянию на июль 2023 г. более 200 гайдлайнов фармакогенетических консорциумов и регуляторов FDA и EMA, более 760 лекарств, для которых представлены данные публикаций разного уровня доказательства).
PharmGKB начала свою работу в 2000 г. и с тех пор сыграла важную роль в развитии фармакогеномики и персонализированной медицины. База знаний включает в себя широкий спектр данных, в том числе зарегистрированные ассоциации между вариантами генов и ответом на лекарства, аннотации к генам, влияющим на фармакокинетику и фармакодинамику, а также клинические руководства и диаграммы дозировки для различных лекарств.
PharmGKB активно участвует в разработке и распространении клинических руководств в области фармакогенетики. В частности, они работают в тесном сотрудничестве с CPIC и другими организациями, чтобы сформулировать и распространить руководства по использованию результатов фармакогенетического тестирования в клинической практике.
Также PharmGKB обеспечивает доступ к ценной информации для исследователей, включая структурированные знания о взаимодействиях генов и лекарств и данные об ассоциациях, полученные из многочисленных исследований.
Работа PharmGKB сделала значительный вклад в современное понимание взаимодействия генов и лекарств, и они продолжают играть важную роль в продвижении ПМ. Одним из подразделений является DutchPharmacogenetics Working Group (DPWG). Нидерландская рабочая группа по фармакогенетике создана в 2005 г. Работа этой группы сосредоточена на разработке и опубликовании руководств по фармакогенетике, которые используются во всем мире. DPWG состоит из медицинских специалистов и фармакологов, которые вместе работают над созданием универсальных рекомендаций по применению генетической информации в клинической практике.
DPWG известна своей систематической методологией по определению клинического значения фармакогенетической информации и созданию руководств для применения такой информации в клинической практике. Данный консорциум уже разработал более 70 руководств, охватывающих различные гены и лекарства. В руководствах, среди прочего, указывается, какие изменения в дозировке или выборе лекарства могут потребоваться в зависимости от генотипа пациента.
Clinical Pharmacogenetics Implementation Consortium (CPIC) – это ведущий международный консорциум, который создан для облегчения применения фармакогенетических знаний в клинической практике. CPIC был основан в 2009 г. и включает в себя многие ведущие учебные и исследовательские учреждения по всему миру.
Основная задача CPIC – это создание клинических руководств, которые помогают врачам понять, как использовать результаты фармакогенетических тестов для оптимизации лекарственной терапии. Ключевая особенность этих руководств заключается в том, что они направлены не на то, чтобы решить, следует ли проводить фармакогенетическое тестирование, а на то, как интерпретировать имеющиеся результаты тестирования для конкретного пациента.
CPIC разработал и опубликовал множество руководств для различных генов и препаратов, включая антидепрессанты, статины, антикоагулянты и др. Эти руководства основаны на тщательном анализе имеющихся научных данных и обзоре литературы, включают рекомендации по выбору препарата и дозировки в зависимости от генотипа пациента.
Nordic Society of Human Genetics and Precision Medicine – общество создано для координации деятельности скандинавских стран по трансляции в реальную клиническую практику результатов геномных исследований и их использования в рамках внедрения прецизионной медицины для улучшения показателей здоровья населения.
Европейское партнерство по ПМ как часть программы Горизонт 2023. Проект нацелен на поддержку мероприятий, направленных на «обеспечение доступа к инновационному, устойчивому и высококачественному здравоохранению» в странах ЕС.
Одним из основных направлений реализации программы на 2023/24 гг. является ускорение развития персонализированной медицины в ЕС и ассоциированных странах, в том числе посредством государственно-государственного партнерства в области ПМ. Партнерство открыто для всех государств-членов ЕС, а также для стран, связанных с Horizon Europe, и останется открытым для третьих стран, желающих присоединиться. Партнерство базируется на достижениях других ассоциаций инициатив, в том числе 1 млн геномов.
Консорциум PERMIT – консорциум экспертов в области проведения исследований, особенно клинических, для персонализированной медицины. Включает в себя общеевропейскую исследовательскую инфраструктуру (ECRIN, EATRIS, ELIXIR-LU/UNILU), представительство пациентов, фонды, организации, занимающейся оценкой медицинских технологий (ISCIII и KCE), экспертов по защите данных и регуляторике экспертов в науке (MarioNegri Institute (Италия), Université Paris Descartes, Parc Sanitari Sant Joan de Déu (Франция).
Европейский регистр Orphanet. На сегодня зарегистрирована информация о 6172 уникальных РЗ, 71,9 % из которых являются генетическими и 69,9 % из них имеют дебют исключительно в детском возрасте. На основании анализа регистра получены фактические данные о распространенности РЗ в популяции, которая составляет 3,5–5,9 %, что соответствует 263–446 млн человек по всему миру. Принимая во внимание, что в данном анализе не учитывались редкие виды рака и инфекционных заболеваний, число людей, страдающих от РЗ, скорее всего, значительно выше.
Online Mendelian Inheritance in Man (OMIM). По состоянию на август 2020 г. зарегистрировано 9173 наследственных заболеваний, из которых 3308 относятся к заболеваниям, классифицируемым как фенотипы с неизвестной молекулярной основой.
За последнее десятилетие разработано большое количество веб-платформ и баз данных для обмена данными, которые связаны друг с другом через сеть MatchMaker Exchange (MME), для облегчения сопоставления генов-кандидатов. Благодаря этой платформе открыты сотни новых генов. Другие известные веб-платформы: Code for OMIM analysis and figures, Mouse Genome Database, MyGene2, OnlineMendelian Inheritance in Man, PhenoDB, VariantMatcher. Все позволяют пользователям, не знакомым с биоинформатикой, собирать, хранить, анализировать и обмениваться фенотипическими и геномными данными.
LOVD – одна из старейших европейских баз данных, основанная на базе Лейденского Университета в Нидерландах и предназначенная для сбора и отображения вариантов в последовательности ДНК. Изначально она была ориентирована на варианты в генах, ассоциированных с неврологическими и нейромышечными заболеваниями, но сейчас содержит информацию о большинстве генов, ассоциированных с наследственными заболеваниями человека, и, что наиболее ценно, – содержит минимально необходимую информацию о корреляции генотипов и фенотипов, поскольку основной задачей данного ресурса является соотношение между геном и заболеванием. Расширенная клиническая информация из данной базы доступна только для зарегистрированных пользователей.
Ресурс LOVD активно используется врачами-специалистами (клиническими генетиками) для диагностики и консультирования пациентов с генетическими заболеваниями. В настоящее время ресурс LOVDсодержат информацию о более чем более 515 500 генетических вариантов, из которых 124 000 являются уникальными и редкими и касаются более 5000 генов и более 160 000 пациентов.
Human Genome Mutation Database (HGMD). На момент 2017 г. база данных содержала более 203 000 различных генетических вариантов в основном ядерных (не митохондриальных генов), которые вручную были выбраны из научных публикаций и открытых ресурсов. Сегодня база является центральным объединением и хранилище наследственных мутаций, описанных во всем мире исследователями, клиницистами, диагностическими лабораториями и консультантами-генетиками. важный инструмент для аннотирования данных секвенирования следующего поколения.
Общедоступная версия HGMD находится в свободном доступе для зарегистрированных пользователей из академических учреждений и некоммерческих организаций, но полная версия базы доступна только по подписке (HGMD Professional) для академических, клинических и коммерческих пользователей, что является существенным минусом и затрудняет ее использование.
ClinVar – это общедоступный архив отчетов о взаимосвязи между вариантами в геноме человека (точечными, генными, геномными, хромосомными) и фенотипами. Ресурс размещен Национальным центром биотехнологической информации (NCBI) и финансируется за счет Национального института здравоохранения (NIH) США. Для увеличения информативности ресурса ClinVar со временем проект был расширен и привел к созданию научного проекта ClinGen, целью которого является повышение информативности, функциональности и достоверности информации, выкладываемой в ClinVar, а также для поддержки депонирования данных из многих источников. По сути в рамках проекта ClinGen происходит курация данных, свободно выкладываемых в ClinVar, что должно привести к повышению достоверности информации.
PGC – крупнейший консорциум по психиатрической генетике.
SCHEMA – результаты крупнейшего исследования генетики шизофрении.
Многими экономическими агентствами мира прогнозируется резкий прирост рынка персонализированных лекарств, медицинских изделий, информационных технологий, связанных с ПМ. По некоторым прогнозам рынок достигнет к 2030 г. объемов 5,7 трлн дол. США и прирост составит не менее 16 % в год. Самым большим рынком остается Северная Америка, Великобритания, Япония, но рост отмечается в Азии, Европе и др.
Основными группами направлений, где резко растет объем продаж, являются оборудование и расходные материалы для проведения секвенирования нового поколения, персонализированное питание и услуги фитнеса, персонализированные препараты в лечении онкологических заболеваний, рынок персональных медицинских помощников, а также разработка и внедрение информационных систем для разработки лекарственных препаратов.
Основными группами направлений, где резко растет объем продаж, являются оборудование и расходные материалы для проведения секвенирования нового поколения, персонализированное питание и услуги фитнеса, персонализированные препараты в лечении онкологических заболеваний, рынок персональных медицинских помощников, а также разработка и внедрение информационных систем для разработки лекарственных препаратов.
Таблица: Объем рынка и прогноз к 2033 г. в области персонализированной медицины
Крупные компании, которые занимаются технологиями персонализированной медицины
Частные компании в области фармакогенетики играют важнейшую роль в трансляции научных открытий в реальные, доступные и практически применимые решения для пациентов, врачей и больниц. Они активно разрабатывают и предоставляют инновационные сервисы, которые позволяют расшифровать уникальный генетический код каждого индивидуума и использовать эту информацию для создания персонализированных лечебных планов.
– крупная компания, специализирующаяся на предоставлении генетических тестов. Myriad известна своей работой в области онкологии, в частности они предлагают тестирование на BRCA1 и BRCA2, гены, связанные с повышенным риском развития рака груди и яичников. В области фармакогенетики Myriad разработала GeneSight тест, который используется для определения, как пациенты могут реагировать на различные психиатрические лекарства на основе их генетического профиля (около 300 лекарств).
История персонализированной медицины в Российской Федерации. Краткий обзор
1960-80е года
Фармакогенетика активно развивалась в СССР и в России благодаря большому вкладу отечественных фармакологов, генетиков и клиницистов. Интерес отечественных исследователей к фармакогенетике появляется уже в 60-х гг. 20 в. Появлялись публикации, касающиеся таких фармакогенетических феноменов, как повышенная чувствительность к суксаметонию и дефицит глюкозо-6-фосфатдегидрогеназы.
- Так, в 1965 г. в книге «Современные проблемы физиологии и патологии детского возраста» появился раздел «О фавизме и его этиопатогенезе», написанный И.И. Андреевым, в котором были раскрыты проблемы гемолиза при применении некоторых ЛС и продуктов питания у лиц с наследственным дефицитом глюкозо-6-фосфатдегидрогеназы. После выхода этой работы был выполнен ряд исследований по определению частоты дефицита глюкозо-6- фосфатдегидрогеназы в различных регионах СССР.
- А в 1968 г. в журнале «Хирургия» выходит одна из первых статей, посвященных фармакогенетике миорелаксантов. Эта была статья И.М. Теплукновой «Некоторые проблемы фармакогенетики в анестезиологии (обзор литературы)». С этого времени в СССР изучается фармакогенетический феномен повышенной чувствительности к суксаметонию.
- В декабре 1973 г. во РНИМУ им. Н.И. Пирогова создается первая в СССР лаборатория фармакологической генетики, в которой начинают активно проводиться фармакогенетические исследования психотропных ЛС. Сейчас данное подразделение находится в ГУ «НИИ фармакологии имени В.В. Закусова». Главный итог работы лаборатории фармакогенетики в 1975–1980 гг. – формулировка научного положения о закономерности индивидуальных реакций на феназепам и сиднокарб и зависимости эффектов этих и других психотропных средств от генетически детерминированного индивидуального ответа на эмоционально-стрессовое воздействие, что обосновало концепцию индивидуальной психофармакотерапии и профилактики, разработанную А.В. Вальдман в 1979 г. Используя экспериментально-фармакогенетическую методологию, сотрудники лаборатории выявили важные нейрохимические механизмы на уровне ГАМК-А-бензодиазепинового рецепторного комплекса, определяющие возникновение в стрессе реакции страха с замиранием либо активацию поведения.
- В 1974 г. Н.П. Бочков в статье «Состояние и перспективы развития медицинской генетики», опубликованной в Вестнике АМН СССР, подчеркивает большое значение проведения фармакогенетических исследований для оптимизации применения ЛС. В этом же году выходят первые подробные обзоры на русском языке, посвященные состоянию фармакогенетики на тот период времени: «Основные направления генетических исследований в фармакологии», написанный М.О. Мхеидзе, опубликованный в журнале «Клиническая медицина»; «Фармакогенетика, ее достижения и перспективы (обзор литературы)», опубликованный в журнале «Врачебное дело» и написанный Н.П. Скакуном, который двумя годами позже опубликовал первую монографию по фармакогенетике на русском языке «Основы фармакогенетики». В этой монографии изложены основные принципы новой науки. Монография была переиздана со значительными дополнениями в 1981 и 2002 гг., в течение многих лет оставаясь единственным пособием по фармакогенетике на русском языке. В 1976 г. вышло еще несколько обзорных статей по фармакогенетике, написанных коллективом авторов под руководством Н.П. Скакуна.
1980-2000е года
- В 1984 г. выходит еще две монографии по фармакогенетике: «Введение в современную фармакогенетику» и «Основы и педиатрические аспекты фармакогенетики». В настоящее время главы по фармакогенетике присутствуют во всех крупных учебниках и руководствах по фармакологии и клинической фармакологии.
- С конца 1990-х гг. на кафедре клинической фармакологии и пропедевтики внутренних болезней (Первый МГМУ им. И.М. Сеченова) в «НЦЭСМП» Минздрава России активно ведутся клинические фармакогенетические исследования системы биотрансформации (CYP2C9, CYP2D6, CYP3A4) и транспортеров (гликопротеин-Р) лекарственных средств, целью которых является разработка алгоритмов выбора ЛС (непрямые антикоагулянты, сердечные гликозиды, β-адреноблокаторы, статины и др.) и их режимов дозирования в зависимости от генетических особенностей пациентов. Кроме того, у представителей различных этнических групп России и стран СНГ (Казахстан и Азербайджан) проводятся исследования, направленные на изучение частот аллелей и генотипов по клинически значимым аллельным вариантам генов, кодирующих изоферменты цитохрома Р450 и транспортеры ЛС, различия в которых являются основой этнической чувствительности к ЛС. Первым подобным исследованием российского населения г. Воронеж было исследование, выполненное под руководством профессора Ю.Н. Чернова.
2000г - по наше время
- В 2012 г. Указом Президента РФ были определены ключевые задачи развития здравоохранения.
- В 2016 г. была утверждена «Стратегия научно-технологического развития РФ, где одним из приоритетов является переход к персонализированной медицине, высокотехнологичному здравоохранению и технологиям здоровьесбережения, в том числе за счет рационального применения лекарственных препаратов (прежде всего антибактериальных)»(Указ Президента Российской Федерации от 01.12.2016 г. № 642). Понятие персонализированной медицины было далее закреплено в Концепции предиктивной, превентивной и персонализированной медицины (Приказ Министерства здравоохранения РФ от 24 апреля 2018 г. N 186), где постулируется развитие индивидуальных подходов к пациенту, в том числе до развития у него заболеваний, основанных:
- на анализе генетических особенностей и других биомаркеров для выявления предрасположенностей к развитию заболеваний и влияния на риски развития таких заболеваний факторов окружающей среды, применении соответствующих профилактических мер, минимизирующих риски;
- применении персонализированных методов лечения заболеваний и коррекции состояний, включая персонализированное применение лекарственных препаратов и биомедицинских клеточных продуктов, в том числе таргетных (мишень-специфических), основанных на анализе генетических особенностей и других биомаркеров;
- использовании биомаркеров для мониторинга эффективности лечения.
Таким образом, в России в течение нескольких десятков лет проведен ряд исследований по фармакогенетике и персонализированной медицине, а также на законодательном уровне отмечена приоритетность развития данного направления в РФ. Интерес к исследованиям в области персонализированной медицины и фармакогенетики в стране возрастает с каждым годом. Однако на пути к реальной клинической практике фармакогенетика в России, так же, как и во всем мире, сталкивается с пока нерешенными проблемами.
Внедрение технологий персонализированной медицины в систему здравоохранения
Погружение новых, в том числе персонализированных технологий в систему здравоохранения имеет свою определенную логику процесса и характерен для систем здравоохранения большинства стран. Однако в каждой конкретной стране со своей нормативной средой этот процесс всегда имеет свои национальные особенности и регуляторные требования. Поэтому в этой главе будет рассмотрен трек погружение новых, в том числе персонализированных технологий, в систему здравоохранения РФ.
В последнее время наблюдается существенный рост инновационных медицинских технологий, в том числе и в области ПМ, что можно связать с рядом факторов. С одной стороны, это существенный скачок в развитии генетики, молекулярной медицины, что сделало доступным новые методы анализа генома, протеома и других «омик»-данных. Достижения в области биологии по изучению механизмов развития заболеваний позволили подойти к разработке наиболее эффективных медицинских технологий для лечения и диагностики пациентов. С другой стороны, это сбор, анализ и имплементация «больших данных» в медицину, а также применение различных информационных технологий в самых разных и неожиданных сферах науки и медицины.
Такое стремительное развитие медицинской науки и появление новых медицинских технологий не всегда обеспечивает их доступность для системы здравоохранения, в связи с чем предаются забвению на долгие годы.
Неочевидная доступность инновационных медицинских технологий в систему здравоохранения связано с рядом барьеров: ограниченные данные об эффективности и безопасности новых медицинских технологий; отсутствие условий для их применения; необходимость обучения и формирование новых компетенций у медицинского персонала; финансовые ограничения; отсутствие соответствующей нормативно-правовой базы, необходимой для применения новых технологий при оказании соответствующего вида медицинской помощи.
Процесс разработки и дальнейшего продвижения новых медицинских технологий, как правило, сопровождается привлечением инвесторов или венчурного капитала, что обусловлено существенными финансовыми затратами, необходимыми для проведения нужных исследований.
В связи с этим возникает необходимость оценки как инвестиционной привлекательности разрабатываемых технологий на фармацевтический рынок, так и проведения раннего диалога с регулятором, что в совокупности позволяет повысить вероятность внедрения медицинской технологии в систему здравоохранения.
Инвестиционная привлекательность трек погружение – это комплекс факторов и показателей научной, производственной, коммерческой, финансовой и управленческой деятельности, характеризующих особенности инвестиционного потенциала новых технологий, свидетельствующих о целесообразности осуществления и возврате инвестиций. Данный анализ проводится в различных отраслях и для каждой из них он имеет свои особенности, в том числе и для системы здравоохранения. Анализ инвестиционной привлекательности новых технологий в здравоохранении, проводимый на ранних этапах их создания, получил название «ранняя оценка технологий здравоохранения (ОТЗ)» (early HTA). Название связано с широким использованием на данном этапе инструментов оценки технологий здравоохранения, поэтому часто для проведения ранней оценки привлекаются организации, компетентные в вопросах ОТЗ.
В последнее время наблюдается существенный рост инновационных медицинских технологий, в том числе и в области ПМ, что можно связать с рядом факторов. С одной стороны, это существенный скачок в развитии генетики, молекулярной медицины, что сделало доступным новые методы анализа генома, протеома и других «омик»-данных. Достижения в области биологии по изучению механизмов развития заболеваний позволили подойти к разработке наиболее эффективных медицинских технологий для лечения и диагностики пациентов. С другой стороны, это сбор, анализ и имплементация «больших данных» в медицину, а также применение различных информационных технологий в самых разных и неожиданных сферах науки и медицины.
Такое стремительное развитие медицинской науки и появление новых медицинских технологий не всегда обеспечивает их доступность для системы здравоохранения, в связи с чем предаются забвению на долгие годы.
Неочевидная доступность инновационных медицинских технологий в систему здравоохранения связано с рядом барьеров: ограниченные данные об эффективности и безопасности новых медицинских технологий; отсутствие условий для их применения; необходимость обучения и формирование новых компетенций у медицинского персонала; финансовые ограничения; отсутствие соответствующей нормативно-правовой базы, необходимой для применения новых технологий при оказании соответствующего вида медицинской помощи.
Процесс разработки и дальнейшего продвижения новых медицинских технологий, как правило, сопровождается привлечением инвесторов или венчурного капитала, что обусловлено существенными финансовыми затратами, необходимыми для проведения нужных исследований.
В связи с этим возникает необходимость оценки как инвестиционной привлекательности разрабатываемых технологий на фармацевтический рынок, так и проведения раннего диалога с регулятором, что в совокупности позволяет повысить вероятность внедрения медицинской технологии в систему здравоохранения.
Инвестиционная привлекательность трек погружение – это комплекс факторов и показателей научной, производственной, коммерческой, финансовой и управленческой деятельности, характеризующих особенности инвестиционного потенциала новых технологий, свидетельствующих о целесообразности осуществления и возврате инвестиций. Данный анализ проводится в различных отраслях и для каждой из них он имеет свои особенности, в том числе и для системы здравоохранения. Анализ инвестиционной привлекательности новых технологий в здравоохранении, проводимый на ранних этапах их создания, получил название «ранняя оценка технологий здравоохранения (ОТЗ)» (early HTA). Название связано с широким использованием на данном этапе инструментов оценки технологий здравоохранения, поэтому часто для проведения ранней оценки привлекаются организации, компетентные в вопросах ОТЗ.
Для эффективного и управляемого внедрения медицинских технологий в систему здравоохранения раннюю оценку рекомендуется проводить на каждом этапе жизненного цикла технологии для коррекции стратегии их продвижения и повышения инвестиционной привлекательности. При этом оценка на этапах пред- и пострегистрации одинаково важна, так как позволяет оценить перечень и объем необходимых ресурсов, стратегию продвижения, потенциал технологии и ее коммерческую ценность для системы здравоохранения.
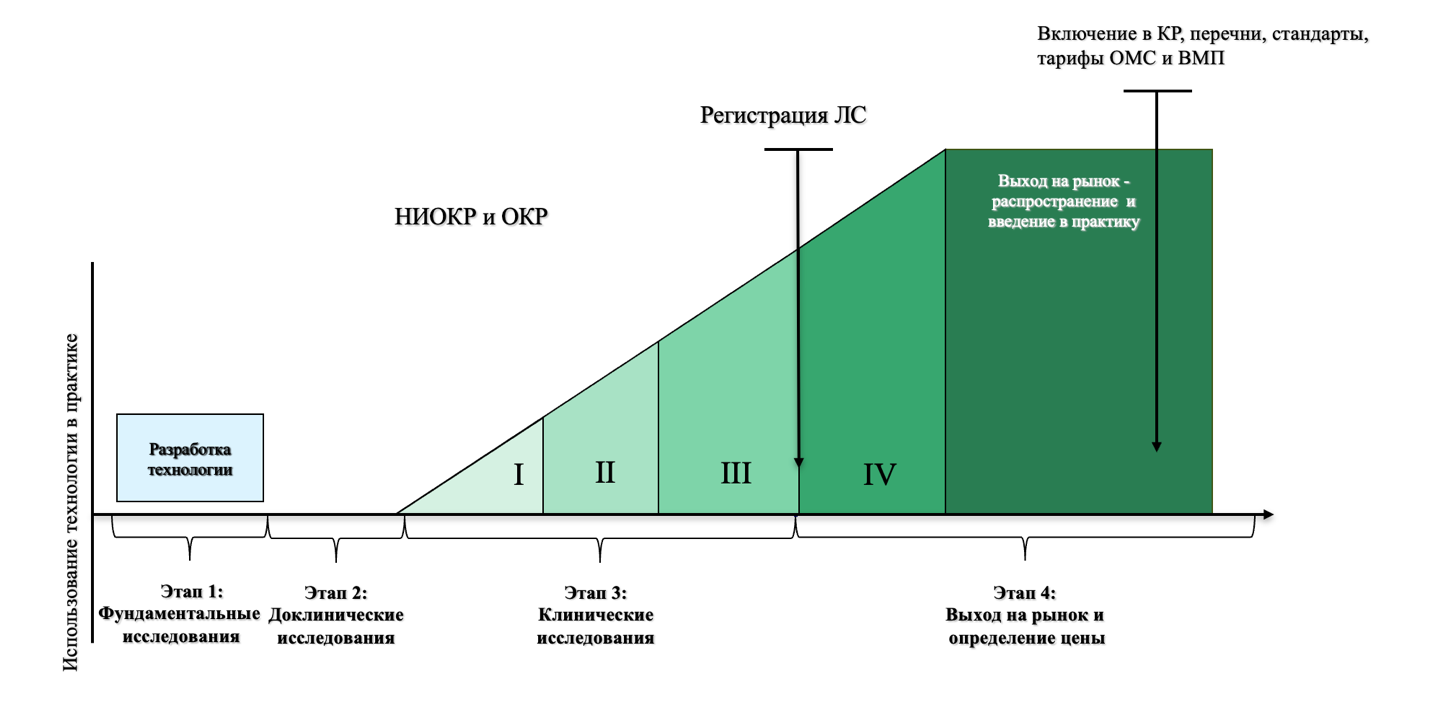
Жизненный цикл медицинской технологии
Для анализа инвестиционной привлекательности целесообразна оценка следующих элементов системы здравоохранения и параметров, связанных с разрабатываемой медицинской технологией:
1.Оценка неудовлетворенных потребностей системы здравоохранения с учетом их приоритетности и идентификации востребованных направлений. Включает в себя сбор и анализ статистических данных, изучение потребностей и определение приоритетов со стороны регулятора, медицинских работников и пациентов. В рамках этого этапа выделяют следующие направления анализа:
3.Оценка бремени заболеваний, являющихся показаниями для назначения новой технологии и анализ влияния на бюджет, которые включают в себя определение воздействия заболеваний и (или) состояний на пациентов, общество и систему здравоохранения через такие параметры, как смертность, продолжительность жизни, заболеваемость, качество жизни, частота обращений за медицинской помощью, количество госпитализаций, затраты на лечение, инвалидность и др. Отдельно оценивается ожидаемые параметры клинической эффективности и безопасности новых технологий.
4.Идентификация «готовности» системы здравоохранения, включая диагностику, лечение и профилактику, к разрабатываемой технологии в соответствии с текущей нормативно-правовой документацией, регламентирующей условия оказания медицинской помощи. Данный этап включает в себя анализ нормативно-правовой базы, в том числе клинические рекомендации, порядки и стандарты медицинской помощи, а также оценку соответствия новых технологий текущей практики оказания медицинской помощи.
5.Определение клинико-экономической приемлемости новых технологий, включая проведение систематического обзора литературы по оценке эффективности и безопасности технологий сравнения, разработку клинико-экономической модели течения заболевания и определение приемлемых для системы здравоохранения цен и затрат.
Конечным этапом оценки инвестиционной привлекательности является разработка бизнес-плана, содержащего в себе оценку среды, в которую погружается новая медицинская технология, в том числе конкурентной, возможные последствия от ее внедрения, а также потенциальные риски и пути их решения. Риски, особенно на этапе разработки, сопровождаются неизвестными параметрами, характеризующими технологию, что требует также описания проведения мероприятий для получения недостающих данных и полноценной оценки последствий выхода технологии на фармацевтический рынок.
Анализ инвестиционной привлекательности является важной частью разработки и дальнейшего продвижения любой медицинской технологии, результаты которой важны как для разработчика, так и для потенциальных инвесторов, которые будут заинтересованы в ее финансировании. К потенциальным инвесторам можно отнести государство, что делает дальнейший диалог с регулятором еще более актуальным. Данная оценка может быть проведена любым заинтересованным участником системы здравоохранения, включая также институты и научные сообщества.
В международной практике вопросами оценки инвестиционной привлекательности занимаются зарубежные ОТЗ агентства, а также частные организации, определяющие потенциал новых разработок. В РФ вопросами оценки и внедрения инновационных медицинских технологий занимаются Центры трансфера медицинских технологий, Центр поддержки внедрения новых технологий, а также институты трансляционной медицины, базирующиеся на базах научно-исследовательских центров.
Учитывая важность преодоления регуляторных требований для эффективного внедрения инновационной медицинской технологии сегодня создаются «институты научного консультирования». В рамках научного консультирования организуются встречи заявителей (разработчиков) с регулятором или так называемые ранние диалоги, представляющие собой структурированные, систематические процессы, обеспечивающие предоставление и обсуждение данных, необходимых для принятия положительных решений в отношении медицинских технологий в соответствии с требованиями регулятора. Целью этого процесса является консультирование по вопросам потенциальной эффективности и безопасности медицинской технологии, дизайна, объема выборки, анализируемых исходов и сравниваемых альтернатив планируемых клинических исследований для обеспечения возможности регистрации новой технологии.
Процедура проведения научного консультирования подразумевает наличие регулирующего органа, осуществляющего диалог с разработчиками и (или) производителями, благодаря которой заявитель получает рекомендации в отношении необходимых доказательств и как следствие – комплекса мероприятий, которые ему необходимо совершить для успешной регистрации медицинской технологии.
В том случае, если разработчик и (или) производитель планирует дальнейшее внедрение разрабатываемой медицинской технологии в систему здравоохранения, ее финансирование или возмещение, то в рамках научного консультирования также привлекаются представители ОТЗ агентств, которые дают рекомендации в отношении данных, необходимых для этого этапа продвижения новых технологий.
В отношении раннего диалога с регуляторными органами в рамках ЕАЭС согласно статье 26 Решения № 7836 регламентировано проведение уполномоченными органами или экспертными организациями государств-членов по запросу заявителя научных и предрегистрационных консультаций в соответствии с законодательством государств-членов, однако отдельного нормативно-правового акта ЕАЭС по механизму консультирования пока не принято. На практике консультации проводятся до подачи заявления на регистрацию ЛП по вопросам, связанным с проведением фундаментальных, прикладных или клинических исследований, аспектам процедуры регистрации, формата подачи заявления и регистрационного досье, по вопросам предоставления образцов ЛП, стандартных образцов и других материалов, необходимых для проведения лабораторной экспертизы качества, и по другим вопросам.
Проведение научного консультирования может сопровождаться обсуждением следующих направлений, касающихся новых медицинских технологий:
Разработка и дальнейшее продвижение новой медицинской технологии является сложным процессом, обусловленным возникающими рисками, связанными с параметрами, характеризующими медицинскую технологию, включая оценку его эффективности и безопасности, а также влияния на течение заболевания, и особенностями конкретной системы здравоохранения, особенно в начале жизненного цикла медицинского продукта. Однако при должном использовании мер, включающих оценку инвестиционной привлекательности, а также проведения раннего диалога с регулятором и ОТЗ-агентством, можно минимизировать риски неудачи, связанные с внедрением технологии здравоохранения в систему здравоохранения.
Следующим этапом продвижения новых технологий является их «погружение» в систему национального (бюджетного и страхового) финансирования. Начало этого этапа определяется процедурой регистрации продукта уполномоченным органом исполнительной власти (Министерство здравоохранения РФ) для лекарственных препаратов и Федеральной службой по надзору в сфере здравоохранения для медицинских изделий.
В настоящее время в РФ медицинская помощь организуется и оказывается на основе клинических рекомендаций, которые занимают центральное место в системе стандартизации здравоохранения. Именно на их основе разрабатываются документы, определяющие медицинскую помощь и финансирование системы здравоохранения: стандарты медицинской помощи, и документы, определяющие качество медицинской помощи – критерии оценки качества медицинской помощи. Кроме того, клинические рекомендации являются документами, помогающими врачам принимать решения о выборе тактики лечения пациентов, влияют на клиническую практику и способствуют повышению качества медицинской помощи путем внедрения в практику современных и эффективных методов лечения. Именно это определяет стратегию погружения новых и персонализированных технологий в систему здравоохранения.
С этой точки зрения, зона ответственности трансляционной медицины расширяется и должна охватывать процессы погружения технологий в систему государственного или страхового финансирования, т.е. до момента обеспечения доступности новых технологий для каждого нуждающегося в них пациента.
Клинические рекомендации разрабатываются медицинскими профессиональными некоммерческими организациями (МПНКО) в соответствии с установленным порядком разработки и требованиями, установленными приказами Минздрава России. Благодаря тому, что процесс разработки клинических рекомендаций четко регламентирован, требования к доказательным аргументам и необходимым клиническим исследованиям представляются понятными и прогнозируемыми.
В соответствии с текущими требованиями перечень заболеваний, для которых должны быть разработаны клинические рекомендации, устанавливается Минздравом России. В случае появление новых технологий для заболеваний, не входящих в перечень Минздрава, их разработчик всегда может инициировать разработку соответствующих клинических рекомендаций сверх утвержденного перечня совместно с профильными МПНКО.
Включение новых лекарственный препаратов в клинические рекомендации осуществляется с указанием модели пациента и, при необходимости, клинической ситуации. Включение медицинских изделий, диагностических тестов или других технологий в клинические рекомендации происходит через конкретные методы и способы диагностики и лечения, также с определением модели пациента и клинической ситуации.
В этом случае для включения новых технологий возможно «прописание» определенных медицинских услуг, конкретизирующих описанные методы диагностики и лечения. Предложенные в клинических рекомендациях тезисы о медицинских услугах, лекарственных препаратах и медицинских изделиях должны быть подтверждены научным обоснованием через указание УДД и УУР.
Анализируя развитие и внедрение подходов технологий ПМ следует отдельно остановиться на треках внедрения различных технологий. Лекарственные препараты, такие как орфанные препараты, CAR-T технологии, генные препараты, достаточно просто вписываются в соответствующие разделы лечения с указанием УДД и УУР.
В случае необходимости включения диагностических тестов, определяющих тактику и выбор популяции пациентов (исследований для определения вариантов генов, фармакогенетические исследования и др.), в соответствующих разделах клинических рекомендаций также указывается необходимость их проведения с указанием УДД и УУР. В случае описания диагностических тестов степень их конкретизации может быть различна – от указания необходимости проведения того или иного исследования до прописания названия конкретной медицинской услуги с указанием конкретного метода проведения исследований.
Клинические рекомендации, проведшие процедуру экспертизы, далее проходят процедуру одобрения научно-практическим советом (НПС). НПС является постоянно действующим органом при Минздраве России, созданным для рассмотрения клинических рекомендаций и принятия решений об их одобрении, отклонении или направлении клинических рекомендаций на доработку. Одобренные и утвержденные МПНКО и клинические рекомендации размещаются в Рубрикаторе клинических рекомендаций Минздрава России (Рубрикатор). Следует отметить, что на законодательном уровне определены сроки пересмотра клинических рекомендаций: не реже одного раза в три года и не чаще одного раза в шесть месяцев. Это дает возможность разработчикам и заявителям уже через шесть месяцев инициировать актуализацию клинических рекомендаций для погружения в них новых, не включенных ранее технологий.
1.Оценка неудовлетворенных потребностей системы здравоохранения с учетом их приоритетности и идентификации востребованных направлений. Включает в себя сбор и анализ статистических данных, изучение потребностей и определение приоритетов со стороны регулятора, медицинских работников и пациентов. В рамках этого этапа выделяют следующие направления анализа:
- оценка организации и финансирования системы здравоохранения, включая структуру, ресурсы, население, демографию, целевую аудиторию анализируемых технологий, уровень доступности медицинской помощи, анализ текущих проблем в здравоохранении и запросов населения и т.д.;
- изучение неудовлетворенных потребностей по лечению и диагностики анализируемых заболеваний ( проведение опросов и фокус-групп с клиническими экспертами и пациентами);
- учет тяжести и распространенности оцениваемых заболеваний и (или) состояний, экономические аспекты, каналы финансирования, существующие программы лечения, а также множество других критериев, характеризующих предмет оценки. На основании полученных данных определяются приоритетные сегменты (целевая аудитория) заболеваний и (или) состояний. Данный этап также сопровождается участием регулятора, плательщиков, клинических экспертов и других заинтересованных сторон.
3.Оценка бремени заболеваний, являющихся показаниями для назначения новой технологии и анализ влияния на бюджет, которые включают в себя определение воздействия заболеваний и (или) состояний на пациентов, общество и систему здравоохранения через такие параметры, как смертность, продолжительность жизни, заболеваемость, качество жизни, частота обращений за медицинской помощью, количество госпитализаций, затраты на лечение, инвалидность и др. Отдельно оценивается ожидаемые параметры клинической эффективности и безопасности новых технологий.
4.Идентификация «готовности» системы здравоохранения, включая диагностику, лечение и профилактику, к разрабатываемой технологии в соответствии с текущей нормативно-правовой документацией, регламентирующей условия оказания медицинской помощи. Данный этап включает в себя анализ нормативно-правовой базы, в том числе клинические рекомендации, порядки и стандарты медицинской помощи, а также оценку соответствия новых технологий текущей практики оказания медицинской помощи.
5.Определение клинико-экономической приемлемости новых технологий, включая проведение систематического обзора литературы по оценке эффективности и безопасности технологий сравнения, разработку клинико-экономической модели течения заболевания и определение приемлемых для системы здравоохранения цен и затрат.
- При выполнении данного этапа может быть использовано несколько методов, применение которых обусловлено той фазой жизненного цикла, в которой находится инновационная медицинская технология. Так для медицинской технологии, находящейся на этапе разработки (фундаментальные и прикладные исследования) целесообразно применение симуляционных клинических исследований (In silico).
- Данный подход компьютерного моделирования (симуляции) посредством построения математических моделей на основании обобщенных предварительных данных (эффективность, прогрессирование заболевания, вариабельности пациентов, затраты и др.) позволяет спрогнозировать клиническую картину у различных групп пациентов, а также определить условия, при которых новая технология сможет представлять интерес для системы здравоохранения. Полученные результаты позволят получить некоторую определенность в отношении целесообразности проведения дальнейших клинических исследований и в случае отрицательного прогноза избежать неоправленных инвестиций.
- Другой подход включает в себя ранее экономическое моделирование, применение которого возможно при первичном получении данных об эффективности медицинской технологии, что позволит оценить клинико-эконмические последствия от применения новой медицинской технологии.
Конечным этапом оценки инвестиционной привлекательности является разработка бизнес-плана, содержащего в себе оценку среды, в которую погружается новая медицинская технология, в том числе конкурентной, возможные последствия от ее внедрения, а также потенциальные риски и пути их решения. Риски, особенно на этапе разработки, сопровождаются неизвестными параметрами, характеризующими технологию, что требует также описания проведения мероприятий для получения недостающих данных и полноценной оценки последствий выхода технологии на фармацевтический рынок.
Анализ инвестиционной привлекательности является важной частью разработки и дальнейшего продвижения любой медицинской технологии, результаты которой важны как для разработчика, так и для потенциальных инвесторов, которые будут заинтересованы в ее финансировании. К потенциальным инвесторам можно отнести государство, что делает дальнейший диалог с регулятором еще более актуальным. Данная оценка может быть проведена любым заинтересованным участником системы здравоохранения, включая также институты и научные сообщества.
В международной практике вопросами оценки инвестиционной привлекательности занимаются зарубежные ОТЗ агентства, а также частные организации, определяющие потенциал новых разработок. В РФ вопросами оценки и внедрения инновационных медицинских технологий занимаются Центры трансфера медицинских технологий, Центр поддержки внедрения новых технологий, а также институты трансляционной медицины, базирующиеся на базах научно-исследовательских центров.
Учитывая важность преодоления регуляторных требований для эффективного внедрения инновационной медицинской технологии сегодня создаются «институты научного консультирования». В рамках научного консультирования организуются встречи заявителей (разработчиков) с регулятором или так называемые ранние диалоги, представляющие собой структурированные, систематические процессы, обеспечивающие предоставление и обсуждение данных, необходимых для принятия положительных решений в отношении медицинских технологий в соответствии с требованиями регулятора. Целью этого процесса является консультирование по вопросам потенциальной эффективности и безопасности медицинской технологии, дизайна, объема выборки, анализируемых исходов и сравниваемых альтернатив планируемых клинических исследований для обеспечения возможности регистрации новой технологии.
Процедура проведения научного консультирования подразумевает наличие регулирующего органа, осуществляющего диалог с разработчиками и (или) производителями, благодаря которой заявитель получает рекомендации в отношении необходимых доказательств и как следствие – комплекса мероприятий, которые ему необходимо совершить для успешной регистрации медицинской технологии.
В том случае, если разработчик и (или) производитель планирует дальнейшее внедрение разрабатываемой медицинской технологии в систему здравоохранения, ее финансирование или возмещение, то в рамках научного консультирования также привлекаются представители ОТЗ агентств, которые дают рекомендации в отношении данных, необходимых для этого этапа продвижения новых технологий.
В отношении раннего диалога с регуляторными органами в рамках ЕАЭС согласно статье 26 Решения № 7836 регламентировано проведение уполномоченными органами или экспертными организациями государств-членов по запросу заявителя научных и предрегистрационных консультаций в соответствии с законодательством государств-членов, однако отдельного нормативно-правового акта ЕАЭС по механизму консультирования пока не принято. На практике консультации проводятся до подачи заявления на регистрацию ЛП по вопросам, связанным с проведением фундаментальных, прикладных или клинических исследований, аспектам процедуры регистрации, формата подачи заявления и регистрационного досье, по вопросам предоставления образцов ЛП, стандартных образцов и других материалов, необходимых для проведения лабораторной экспертизы качества, и по другим вопросам.
Проведение научного консультирования может сопровождаться обсуждением следующих направлений, касающихся новых медицинских технологий:
- параметров качества разрабатываемого медицинского продукта, включая производство, фармацевтические, биологические испытания технологии и т.д.;
- проведения доклинических исследований (например, тесты, определяющие эффективность медицинской технологии);
- проведения клинических исследований (например, выбор конечных точек, определение целесообразности проведения исследования на конкретной популяции с определенной альтернативой и др.);
- методологических параметров (методы оценки данных, проведение анализа данных, требования к моделированию и др.);
- общей стратегии развития (определение ожидаемого места медицинской технологии в практике лечения, потенциал возмещения и др.).
Разработка и дальнейшее продвижение новой медицинской технологии является сложным процессом, обусловленным возникающими рисками, связанными с параметрами, характеризующими медицинскую технологию, включая оценку его эффективности и безопасности, а также влияния на течение заболевания, и особенностями конкретной системы здравоохранения, особенно в начале жизненного цикла медицинского продукта. Однако при должном использовании мер, включающих оценку инвестиционной привлекательности, а также проведения раннего диалога с регулятором и ОТЗ-агентством, можно минимизировать риски неудачи, связанные с внедрением технологии здравоохранения в систему здравоохранения.
Следующим этапом продвижения новых технологий является их «погружение» в систему национального (бюджетного и страхового) финансирования. Начало этого этапа определяется процедурой регистрации продукта уполномоченным органом исполнительной власти (Министерство здравоохранения РФ) для лекарственных препаратов и Федеральной службой по надзору в сфере здравоохранения для медицинских изделий.
В настоящее время в РФ медицинская помощь организуется и оказывается на основе клинических рекомендаций, которые занимают центральное место в системе стандартизации здравоохранения. Именно на их основе разрабатываются документы, определяющие медицинскую помощь и финансирование системы здравоохранения: стандарты медицинской помощи, и документы, определяющие качество медицинской помощи – критерии оценки качества медицинской помощи. Кроме того, клинические рекомендации являются документами, помогающими врачам принимать решения о выборе тактики лечения пациентов, влияют на клиническую практику и способствуют повышению качества медицинской помощи путем внедрения в практику современных и эффективных методов лечения. Именно это определяет стратегию погружения новых и персонализированных технологий в систему здравоохранения.
С этой точки зрения, зона ответственности трансляционной медицины расширяется и должна охватывать процессы погружения технологий в систему государственного или страхового финансирования, т.е. до момента обеспечения доступности новых технологий для каждого нуждающегося в них пациента.
Клинические рекомендации разрабатываются медицинскими профессиональными некоммерческими организациями (МПНКО) в соответствии с установленным порядком разработки и требованиями, установленными приказами Минздрава России. Благодаря тому, что процесс разработки клинических рекомендаций четко регламентирован, требования к доказательным аргументам и необходимым клиническим исследованиям представляются понятными и прогнозируемыми.
В соответствии с текущими требованиями перечень заболеваний, для которых должны быть разработаны клинические рекомендации, устанавливается Минздравом России. В случае появление новых технологий для заболеваний, не входящих в перечень Минздрава, их разработчик всегда может инициировать разработку соответствующих клинических рекомендаций сверх утвержденного перечня совместно с профильными МПНКО.
Включение новых лекарственный препаратов в клинические рекомендации осуществляется с указанием модели пациента и, при необходимости, клинической ситуации. Включение медицинских изделий, диагностических тестов или других технологий в клинические рекомендации происходит через конкретные методы и способы диагностики и лечения, также с определением модели пациента и клинической ситуации.
В этом случае для включения новых технологий возможно «прописание» определенных медицинских услуг, конкретизирующих описанные методы диагностики и лечения. Предложенные в клинических рекомендациях тезисы о медицинских услугах, лекарственных препаратах и медицинских изделиях должны быть подтверждены научным обоснованием через указание УДД и УУР.
Анализируя развитие и внедрение подходов технологий ПМ следует отдельно остановиться на треках внедрения различных технологий. Лекарственные препараты, такие как орфанные препараты, CAR-T технологии, генные препараты, достаточно просто вписываются в соответствующие разделы лечения с указанием УДД и УУР.
В случае необходимости включения диагностических тестов, определяющих тактику и выбор популяции пациентов (исследований для определения вариантов генов, фармакогенетические исследования и др.), в соответствующих разделах клинических рекомендаций также указывается необходимость их проведения с указанием УДД и УУР. В случае описания диагностических тестов степень их конкретизации может быть различна – от указания необходимости проведения того или иного исследования до прописания названия конкретной медицинской услуги с указанием конкретного метода проведения исследований.
Клинические рекомендации, проведшие процедуру экспертизы, далее проходят процедуру одобрения научно-практическим советом (НПС). НПС является постоянно действующим органом при Минздраве России, созданным для рассмотрения клинических рекомендаций и принятия решений об их одобрении, отклонении или направлении клинических рекомендаций на доработку. Одобренные и утвержденные МПНКО и клинические рекомендации размещаются в Рубрикаторе клинических рекомендаций Минздрава России (Рубрикатор). Следует отметить, что на законодательном уровне определены сроки пересмотра клинических рекомендаций: не реже одного раза в три года и не чаще одного раза в шесть месяцев. Это дает возможность разработчикам и заявителям уже через шесть месяцев инициировать актуализацию клинических рекомендаций для погружения в них новых, не включенных ранее технологий.
На основе клинических рекомендаций, размещенных в Рубрикаторе, разрабатываются стандарты медицинской помощи, позволяющие оценить финансовую потребность на оказание медицинской помощи в рамках Программы государственных гарантий бесплатного оказания гражданам медицинской помощи (ПГГ). Ответственность за разработку стандартов медицинской помощи лежит на главных внештатных специалистах Минздрава России
В соответствии с законодательством, в клинические рекомендации и стандарты медицинской помощи возможно включение только зарегистрированных лекарственных препаратов. В клинические рекомендации допускается включение off-label лекарственных препаратов с их отдельной пометкой, а для стандартов включение таких технологий возможно только для детей при определенных заболеваниях.
При оказании медицинской помощи в рамках ПГГ предусмотрено обеспечение граждан лекарственными препаратами, включенными в перечень жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП). Таком образом, обязательным условием включения лекарственных препаратов в ПГГ и способы оплаты медицинской помощи помимо включения в клинические рекомендации и стандарты медицинской помощи, является включение в перечень ЖНВЛП.
Для медицинских изделий на законодательном уровне каких-либо ограничений по включению медицинских изделий и диагностических тестов в клинические рекомендации, в отличие от стандартов медицинской помощи, не установлено. В стандарты медицинской помощи включаются только имплантируемые медицинские изделия, включенные в определенный законодательством перечень. Медицинские изделия применяются при оказании медицинской помощи в рамках выполнения тех или иных медицинских услуг. Поэтому для медицинских изделий можно обозначить еще один ключевой этап, необходимый для погружения в ПГГ, – включение медицинской услуги при выполнении которой используется медицинское изделие в номенклатуру медицинских услуг, вне зависимости от того, является медицинское изделие имплантируемым или нет. Так как без включения в номенклатуру медицинских услуг, даже при описании в клинические рекомендации, включение медицинского вмешательства в стандарты медицинской помощи не представляется возможным.
В РФ перечень медицинских услуг представлен в так называемой номенклатуре медицинских услуг, которая утверждается показом Минздрава России. Таким образом, при погружении диагностических тестов или других медицинских исследований в клинических рекомендациях необходимо прописать медицинскую услугу, метод диагностики или лечения. Параллельно для обеспечения доступности этих методов, необходимо внести в номенклатуру соответствующие медицинские услуги, а при продвижении диагностических тестов необходима их государственная регистрация.
Для медицинских изделий в системе здравоохранения существует еще одно условие для их реализации в ПГГ – это включение в ограничительный перечень имплантируемых медицинских изделий, утверждаемый Правительством РФ, по аналогии с перечнем ЖНВЛП для лекарственных препаратов, только после включения в перечень имплантируемые медицинские изделия могут быть указаны в стандарте медицинской помощи.
Включение в клинические рекомендации медицинских технологий требует подтверждения их научной обоснованности. И если для лекарственных препаратов, как правило, определенная доказательная база к моменту регистрации лекарственного препараты уже сформирована, то с медицинскими изделиями ситуация может быть сложнее.
В стандарты медицинской помощи включаются медицинские услуги в соответствии с номенклатурой медицинских услуг, зарегистрированные лекарственные препараты, диагностические тесты и медицинские изделия, имплантируемые в организм человека, компоненты крови и лечебное питание, в том числе специализированные продукты питания. Для каждого компонента стандарта рассчитываются числовые значения усредненные показатели частоты и кратности применения или для лекарственных препаратов суточные и курсовые дозы, что позволяет проводить по стандартам экономические расчеты. Соответственно частота представления, длительность назначения тех или иных технологий, и в том числе технологий персонализированной медицины, определяется главным внештатным специалистом на основе тезисов, приведенных в клинических рекомендациях.
Стандарты медицинской помощи через усредненные показатели частоты и кратности применения лекарственных препаратов, медицинских изделий, диагностических тестов и других технологий могут определять потребность системы в их применении, а также в идеале должны быть увязаны с нормативами медицинской помощи, принятыми в ПГГ, как для круглосуточного и дневного стационара, так и для амбулаторной медицинской помощи (например, случаев госпитализации и частота МГИ).
При оказании медицинской помощи в рамках ПГГ предусмотрено обеспечение граждан лекарственными препаратами, включенными в перечень жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП). Таком образом, обязательным условием включения лекарственных препаратов в ПГГ и способы оплаты медицинской помощи помимо включения в клинические рекомендации и стандарты медицинской помощи, является включение в перечень ЖНВЛП.
Для медицинских изделий на законодательном уровне каких-либо ограничений по включению медицинских изделий и диагностических тестов в клинические рекомендации, в отличие от стандартов медицинской помощи, не установлено. В стандарты медицинской помощи включаются только имплантируемые медицинские изделия, включенные в определенный законодательством перечень. Медицинские изделия применяются при оказании медицинской помощи в рамках выполнения тех или иных медицинских услуг. Поэтому для медицинских изделий можно обозначить еще один ключевой этап, необходимый для погружения в ПГГ, – включение медицинской услуги при выполнении которой используется медицинское изделие в номенклатуру медицинских услуг, вне зависимости от того, является медицинское изделие имплантируемым или нет. Так как без включения в номенклатуру медицинских услуг, даже при описании в клинические рекомендации, включение медицинского вмешательства в стандарты медицинской помощи не представляется возможным.
В РФ перечень медицинских услуг представлен в так называемой номенклатуре медицинских услуг, которая утверждается показом Минздрава России. Таким образом, при погружении диагностических тестов или других медицинских исследований в клинических рекомендациях необходимо прописать медицинскую услугу, метод диагностики или лечения. Параллельно для обеспечения доступности этих методов, необходимо внести в номенклатуру соответствующие медицинские услуги, а при продвижении диагностических тестов необходима их государственная регистрация.
Для медицинских изделий в системе здравоохранения существует еще одно условие для их реализации в ПГГ – это включение в ограничительный перечень имплантируемых медицинских изделий, утверждаемый Правительством РФ, по аналогии с перечнем ЖНВЛП для лекарственных препаратов, только после включения в перечень имплантируемые медицинские изделия могут быть указаны в стандарте медицинской помощи.
Включение в клинические рекомендации медицинских технологий требует подтверждения их научной обоснованности. И если для лекарственных препаратов, как правило, определенная доказательная база к моменту регистрации лекарственного препараты уже сформирована, то с медицинскими изделиями ситуация может быть сложнее.
В стандарты медицинской помощи включаются медицинские услуги в соответствии с номенклатурой медицинских услуг, зарегистрированные лекарственные препараты, диагностические тесты и медицинские изделия, имплантируемые в организм человека, компоненты крови и лечебное питание, в том числе специализированные продукты питания. Для каждого компонента стандарта рассчитываются числовые значения усредненные показатели частоты и кратности применения или для лекарственных препаратов суточные и курсовые дозы, что позволяет проводить по стандартам экономические расчеты. Соответственно частота представления, длительность назначения тех или иных технологий, и в том числе технологий персонализированной медицины, определяется главным внештатным специалистом на основе тезисов, приведенных в клинических рекомендациях.
Стандарты медицинской помощи через усредненные показатели частоты и кратности применения лекарственных препаратов, медицинских изделий, диагностических тестов и других технологий могут определять потребность системы в их применении, а также в идеале должны быть увязаны с нормативами медицинской помощи, принятыми в ПГГ, как для круглосуточного и дневного стационара, так и для амбулаторной медицинской помощи (например, случаев госпитализации и частота МГИ).
Математические модели, используемые при разработке стандартов, через разработку стандартизируемых модулей позволяют выстраивать взаимосвязи исходя из вариативности имеющихся методов диагностики и лечения, последовательности их применения для популяций пациентов в соответствии с клиническими рекомендациями, а также определять вероятности и кратности применения в популяции пациентов. Описанный подход по согласованию стандартов медицинской помощи, с одной стороны, позволяет рассчитать более объективные значения усредненных показателей частоты и кратности применения для компонентов стандартов, а с другой – согласовать стандарты с единицами планирования ПГГ и использовать для целей актуализации методов оплаты медицинской помощи в рамках ПГГ
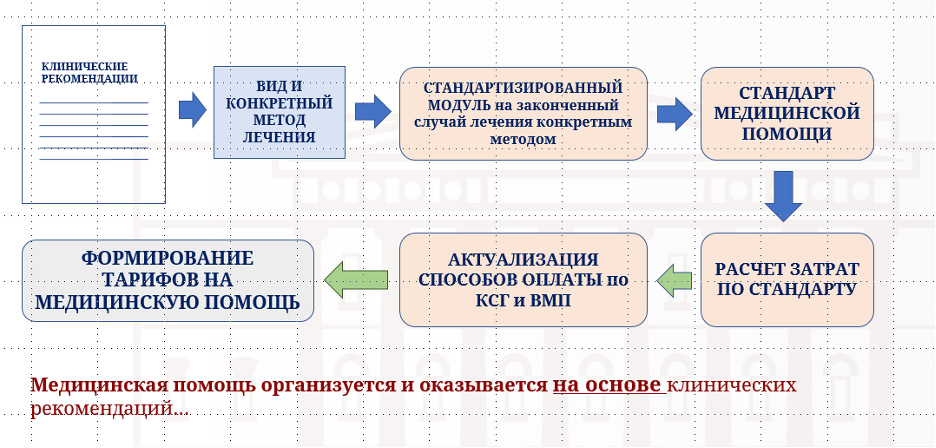
Рис. Определение необходимых бюджетов и актуализация способов оплаты медицинской помощи
Стандарты медицинской помощи не определяют тарифы оплаты медицинской помощи, однако на их основании оценивается прогноз необходимого финансирования заболеваний и происходит актуализация клинико-статистических групп (КСГ) и перечней высокотехничной медицинской помощи (ВМП).
Программы государственных гарантий бесплатного оказания гражданам медицинской помощи в системе здравоохранения РФ является основным документом, определяющим гарантии граждан на получение медицинской помощи. При этом следует отметить, что ПГГ в общем определяет объемы финансирования на оказание медицинской помощи за счет средств разных бюджетов. В ПГГ определены средние нормативы объема оказания и средние нормативы финансовых затрат на единицу объема медицинской помощи, способы оплаты медицинской помощи по условиям оказания. В ПГГ имеется конкретизация отдельных медицинских вмешательств в виде перечней ВМП и перечня отдельных диагностических исследований. Но большая конкретизация методов диагностики и лечения представлена в модели КСГ, в которой в качестве классификационных критериев, позволяющих отнести случай оказания медицинской помощи к той или иной КСГ, представлена номенклатура медицинских услуг или другой классификационный критерий.
Следует отметить, что при наличии потребности приоритезировать применение того или иного препарата, лечебную или диагностическую услугу, необходимо, с одной стороны, учесть их стоимость при расчете коэффициента затратоемкости, а с другой – внести их в перечень классификационных критериев, определяющих соответствующее дополнительное их финансирование. Другой путь, применяемый для амбулаторной практики, – погружение отдельной услуги с указанием финансовых нормативов и нормативов объема медицинской помощи.
Отдельно следует выделить закрепленную в законодательстве РФ процедуру проведения клинической апробации для подтверждения доказательств эффективности медицинской технологии и в случае положительного результата ее включение в клинические рекомендации и номенклатуру медицинских услуг, стандарты медицинской помощи и определение адекватного пути финансирования. Сегодня этот механизм изучения эффективности новых технологий находит все больший интерес среди научных медицинских организаций.
Программы государственных гарантий бесплатного оказания гражданам медицинской помощи в системе здравоохранения РФ является основным документом, определяющим гарантии граждан на получение медицинской помощи. При этом следует отметить, что ПГГ в общем определяет объемы финансирования на оказание медицинской помощи за счет средств разных бюджетов. В ПГГ определены средние нормативы объема оказания и средние нормативы финансовых затрат на единицу объема медицинской помощи, способы оплаты медицинской помощи по условиям оказания. В ПГГ имеется конкретизация отдельных медицинских вмешательств в виде перечней ВМП и перечня отдельных диагностических исследований. Но большая конкретизация методов диагностики и лечения представлена в модели КСГ, в которой в качестве классификационных критериев, позволяющих отнести случай оказания медицинской помощи к той или иной КСГ, представлена номенклатура медицинских услуг или другой классификационный критерий.
Следует отметить, что при наличии потребности приоритезировать применение того или иного препарата, лечебную или диагностическую услугу, необходимо, с одной стороны, учесть их стоимость при расчете коэффициента затратоемкости, а с другой – внести их в перечень классификационных критериев, определяющих соответствующее дополнительное их финансирование. Другой путь, применяемый для амбулаторной практики, – погружение отдельной услуги с указанием финансовых нормативов и нормативов объема медицинской помощи.
Отдельно следует выделить закрепленную в законодательстве РФ процедуру проведения клинической апробации для подтверждения доказательств эффективности медицинской технологии и в случае положительного результата ее включение в клинические рекомендации и номенклатуру медицинских услуг, стандарты медицинской помощи и определение адекватного пути финансирования. Сегодня этот механизм изучения эффективности новых технологий находит все больший интерес среди научных медицинских организаций.
Таким образом, в процессе погружения новых медицинских технологий персонализированной медицины после их регистрации в РФ можно выделить следующие шаги:
- Включение медицинской технологии в клинические рекомендации (с описанием этапа оказания медицинской помощи и популяции пациентов, которым рекомендовано вмешательство с применением новый медицинской технологии). Погружение лекарственных препаратов и медицинских изделий имеет свои особенности.
- Мероприятия для конкретных технологий:
- лекарственных препаратов – включение в перечень ЖНВЛП (14 ВЗН);
- диагностических тестов – регистрация тестов и включения метода диагностики в перечень номенклатуры медицинских услуг;
- имплантируемых медицинских изделий – в перечень имплантируемых медицинских изделий.
- Включение медицинской технологии в стандарты медицинской помощи, разрабатываемых на основе клинических рекомендаций (определение вероятности и кратности применения в популяции пациентов).
- Расчет дополнительной финансовой потребности на оказание медицинской помощи с применением новой медицинской технологии по условиям оказания медицинской помощи и в разрезе единиц планирования ПГГ; оценка клинических и (или) экономических последствий ее применения.
- Использование программы клинической оценки новых технологий в рамках клинической апробации и на основании ее результатов предлагать исследованный метод для включения в специализированную медицинскую помощь или ВМП.
- Формирование предложений по актуализации способов оплаты медицинской помощи (формирование предложений по включению метода лечения с применением новой медицинской технологии в перечни ВМП, модель КСГ для медицинской помощи, оказываемой в стационарных условиях и условиях дневного стационара, или предложений по выделению норматива в амбулаторных условиях оказания медицинской помощи для диагностического исследования).
- Включение в Программу государственных гарантий бесплатного оказания гражданам медицинской помощи.
Описанные этапы являются ключевыми в процессе погружения новых медицинских технологий в систему здравоохранения, их прохождение делает технологию «видимой, понятной и просчитанной» для системы.
В настоящее время в РФ формируются «институты» и процедуры системного погружения новых, в том числе персонализированных технологий. К ним можно отнести систему ранней оценки и научного консультирования, направленные на ускорение регистрации новых технологий для их легального распространения.
Представленные подходы погружения новых технологий в РФ на пострегистрационном этапе представляются рациональными и понятными для разработчиков и исследователей, основываются на последовательных этапах, что позволяет создать условия для системного и этичного продвижения в систему здравоохранения.
В настоящее время в РФ формируются «институты» и процедуры системного погружения новых, в том числе персонализированных технологий. К ним можно отнести систему ранней оценки и научного консультирования, направленные на ускорение регистрации новых технологий для их легального распространения.
Представленные подходы погружения новых технологий в РФ на пострегистрационном этапе представляются рациональными и понятными для разработчиков и исследователей, основываются на последовательных этапах, что позволяет создать условия для системного и этичного продвижения в систему здравоохранения.
Таким образом, только при прохождении всех представленных этапов могут быть созданы условия обеспечения доступности новых технологий для пациентов. Поэтому в связи со сложностью и научностью реализации данных подходов сегодня следует говорить о расширении трансляционных треков новых технологий на клинические исследования, формировании доказательной аргументной базы, оценке их экономической приемлемости, а также подготовке необходимой научно-обоснованной документации для регуляторного «прописания» новых технологий в системе здравоохранения.
Онкология
Введение
Бремя рака продолжает расти во всем мире, оказывая существенное давление на пациентов, их семьи, сообщества и системы здравоохранения. Рак представляет собой вторую по значимости причину смертности и заболеваемости в мире. По оценке ВОЗ, каждый пятый мужчина и каждая шестая женщина на планете заболеют раком на каком-либо этапе жизни. Изучение процессов канцерогенеза значительно улучшилось за последние два десятилетия, выявив огромные различия не только между типами злокачественных новообразований, но и между пациентами с одним и тем же типом рака. Благодаря этим знаниям противоопухолевое лечение все больше смещается в сторону прецизионных подходов, которые используют системные данные пациентов для принятия персонализированных решений о лечении.
Ключевые особенности прецизионной онкологии
Улучшение результатов лечения пациентов благодаря определению биомаркеров, определяющих оптимальное лечение, частоту ответов и риск побочных эффектов. Данные мета-анализа исследований II фазы, в которых изучалась частота объективного ответа, выживаемость без прогрессирования и общая выживаемость, показал, что пациенты, получавшие противоопухолевое лечение на основе прецизионных подходов, имели более высокие показатели объективного ответа и более низкий процент нежелательных явлений по сравнению с группами стандартного лечения. Прецизионные методы лечения в онкологии используются в более узких показаниях, за счет стремления к ограничению только в тех группах пациентов, которые с наибольшей вероятностью ответят на данный вид терапии.
- Например, одобрение и использование лекарственных средств, нацеленных на EGFR, привело к снижению смертности от рака легкого в США среди мужчин на 6,3 % в период с 2013 по 2016 гг. Опухоль-специфическая общая выживаемость увеличилась с 26 % среди мужчин с диагнозом мНМРЛ в 2001 г. до 35 % в 2014 г. Аналогичные закономерности были обнаружены среди женщин.
- Например, в Нидерландах более широкое использование прецизионной онкологии привело к сокращению продолжительности пребывания в стационаре онкологических больных, при этом средняя продолжительность пребывания в больнице составляет 3–4 дня для пациентов, получающих прецизионные методы лечения, по сравнению с 7 днями для пациентов, получающих стандартную химиотерапию.
- Исследование Французского института рака выявило потенциальную экономию средств, которую может обеспечить молекулярное тестирование за счет сокращения неэффективных назначений.
- Например, вложение 1,7 млн евро в тестирование мутации EGFR во Франции позволило сэкономить 70 млн евро за счет включения только пациентов с НМРЛ, которые ответили на лечение гефитинибом.
Основные направления мировых исследований в области прецизионной онкологии
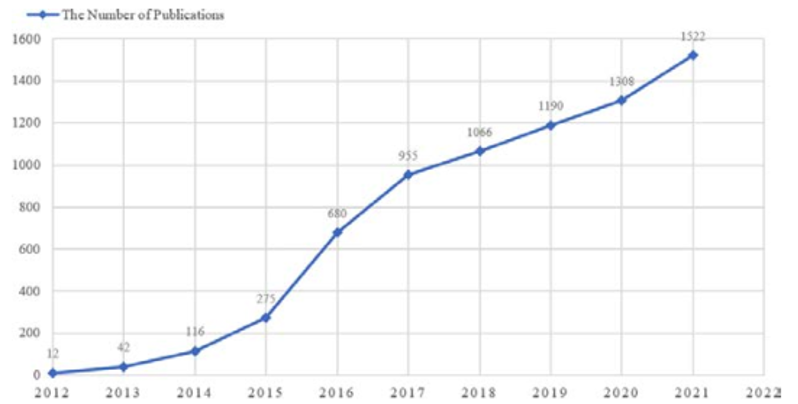
Рис. Увеличение количества публикаций по прецизионной онкологии за последние 10 лет
Важность исследований в области прецизионной онкологии подчеркивается увеличением количества публикаций по прецизионной онкологии за последние 10 лет
В 2018 г. правительство Канады объявило о двух новых крупных инвестициях в исследования в области геномики на общую сумму 255 млн дол. США от федерального правительства и правительств провинций, а также от исследовательских институтов и партнеров из частного сектора.
Precision Medicine Initiative® (PMI) – это инвестиции в размере 215 млн дол. в бюджет Национального института здравоохранения (NIH), направленные на ускорение биомедицинских исследований и предоставление клиницистам новых инструментов для выбора методов лечения, которые можно использовать в индивидуальном подходе к пациентам.
В 2018 г. правительство Канады объявило о двух новых крупных инвестициях в исследования в области геномики на общую сумму 255 млн дол. США от федерального правительства и правительств провинций, а также от исследовательских институтов и партнеров из частного сектора.
Precision Medicine Initiative® (PMI) – это инвестиции в размере 215 млн дол. в бюджет Национального института здравоохранения (NIH), направленные на ускорение биомедицинских исследований и предоставление клиницистам новых инструментов для выбора методов лечения, которые можно использовать в индивидуальном подходе к пациентам.
Таким образом, благодаря проводимым исследованиям и активному финансированию в прецизионной онкологии выделяют следующие направления:
- Развитие агностической таргетной терапии, основанное на генетических аномалиях в опухолях пациентов, независимо от типа рака.
- На основе секвенирования генома опухоли новые клинические испытания:иммунотерапия, тестирование новых комбинаций клеток, антител, малых молекул и лучевой терапии, наномоторов, представляющих собой молекулярные соединения («моторы»), адсорбированные на биослоях активированных ультрафиолетовым светом, со скоростью вращения от 2 до 3 млн оборотов в секунду. Открывая клеточные мембраны и запуская перемещение химических веществ в живые клетки и из них, наномоторы напрямую вызывают гибель клеток. Также разрабатываются планы по созданию консорциума научно-исследовательских учреждений для проведения более глубоких исследований иммунологических характеристик пациентов, получающих иммунотерапию.
- Исследование проблемы резистентности к лечению. Создание репозитория молекулярно-охарактеризованных резистентных образцов из биопсий пациентов. Создание пилотного заочного консорциума по лекарственной устойчивости.
- Разработка новых лабораторных моделей рака человека, основанное на значительном увеличении числа линий раковых клеток человека (выращенных в виде двумерных и трехмерных культур) и ксенотрансплантатов опухолей, полученных от пациентов для разработки лекарств.Запуск инициативы по моделированию рака человека в рамках открытия центров для создания и описания моделей линий раковых клеток нового поколения на основе первичной биопсии и обеспечения их широкого доступа научному сообществу. Пилотная разработка консорциума доклинических моделей.
- Создание консорциума моделей иммунотерапии собак для разработки другой модельной системы, которая может оказаться особенно полезной при изучении лимфом.
- Разработка национальной системы базы данных для размещения и интеграции геномной информации об опухолях с данными о клиническом ответе (например, уменьшение опухоли) и информацией о результатах (например, о продолжительности выживания) в качестве ресурса для ученых, медицинских работников и пациентов.
- Разработка единого масштабируемого репозитория данных о геномике рака, информации о пациентах и реакции на лечение, патологических и рентгенологических изображений и соответствующих доклинических данных.
Развитие успехов в области прецизионной онкологии, сотрудничество с пациентами по всей стране, которые участвуют в клинических испытаниях, спонсируемых национальными институтами онкологии, распространение принципов персонализированной медицины на фундаментальные научные исследования, деятельность в области биомедицинских информационных технологий, результаты организованных исследований позволяют быстрее и эффективнее, чем планировалось или предполагалось ранее, продвигать прецизионную онкологию в мире.
Schwaederle M. et al. Impact of precision medicine in diverse cancers: a meta-analysis of Phase II clinical trials // J Clin Oncol. 2015. 33(32), 3817-25.
Howlader N. et al. The effect of advances in lung-cancer treatment on population mortality // N Engl J Med. 2020. 383, 640–649.
CDDF, ECPC & EFPIA. Joint position paper on personalised oncology. 2019.
Nofziger C., Papaluca M., Terzic A. et al. Policies to aid the adoption of personalized medicine // Nat. Rev. Drug Discov. 2014. 13, 159–160.
Draghia-Akli R. Enabling personalized medicine in Europe: a look at the European Commission’s funding activities in the field of personalized medicine research // Per. Med. 2012. 9, 151–155.
Zhang B., Ao B., Lu X. et al. Global research trends on precision oncology: A systematic review, bibliometrics, and visualized study // Medicine (Baltimore). 2022 Oct 28;101(43):e31380. DOI: 10.1097/MD.0000000000031380. PMID: 36316889; PMCID: PMC9622693
Основные достижения персонализированной медицины в онкологии, примеры успешной реализации в мире
Трастузумаб является хорошо известным примером гуманизированных моноклональных антител IgG, используемого при лечении метастатического рака молочной железы, а также в адьювантных и неоадьювантных режимах, у пациенток с гиперэкспрессией онкогена HER2. HER2 отвечает за пролиферацию опухолевых клеток и имеет избыточную экспрессию у 20–25 % пациентов с раком молочной железы. Положительный статус HER2 свидетельствует о плохом прогнозе, но также является предиктором ответа на трастузумаб. В проведенных исследованиях показано, что трастузумаб, улучшает как безрецидивную выживаемость, так и общую выживаемость пациентов
Рецептор эпидермального фактора роста (EGFR) сверхэкспрессируется при многих эпителиальных раковых заболеваниях, что приводит к нарушению регуляции клеточной пролиферации и агрессивному фенотипу. Таким образом, ингибирование EGFR является многообещающей терапевтической стратегией в исследованиях прецизионной онкологии.
Цетуксимаб, моноклональное антитело, направленное против EGFR, доказал свою эффективность у пациентов мКРР, экспрессирующим KRAS, NRAS дикого типа, который кодирует нижестоящий эффектор EGFR, участвующий во внутриклеточной передаче сигналов. Рандомизированное исследование 572 пациентов мКРР, не отвечающих на стандартную химиотерапию, показало, что статус KRAS «дикого типа» предсказывал ответ на цетуксимаб с улучшением качества жизни и почти вдвое увеличивал общую выживаемость и выживаемость без прогрессирования по сравнению с пациентами с KRAS мутированного типа, получавшими лечение с помощью цетуксимаба.
Таким образом, цетуксимаб лицензирован для лечения мКРР, экспрессирующих ген KRAS дикого типа. Использование статуса KRAS в качестве предиктора ответа на ингибиторы EGFR при мКРР распространяется на другие виды рака, например, немелкоклеточный рак легкого (NSCLC).
Цетуксимаб, моноклональное антитело, направленное против EGFR, доказал свою эффективность у пациентов мКРР, экспрессирующим KRAS, NRAS дикого типа, который кодирует нижестоящий эффектор EGFR, участвующий во внутриклеточной передаче сигналов. Рандомизированное исследование 572 пациентов мКРР, не отвечающих на стандартную химиотерапию, показало, что статус KRAS «дикого типа» предсказывал ответ на цетуксимаб с улучшением качества жизни и почти вдвое увеличивал общую выживаемость и выживаемость без прогрессирования по сравнению с пациентами с KRAS мутированного типа, получавшими лечение с помощью цетуксимаба.
Таким образом, цетуксимаб лицензирован для лечения мКРР, экспрессирующих ген KRAS дикого типа. Использование статуса KRAS в качестве предиктора ответа на ингибиторы EGFR при мКРР распространяется на другие виды рака, например, немелкоклеточный рак легкого (NSCLC).
Существует два основных типа: немелкоклеточный (НМРЛ) и мелкоклеточный рак легкого (МРЛ). Мелкоклеточный составляет около 20 % всех случаев рака легкого. Рак, состоящий из обоих типов, называется смешанным мелкоклеточным/крупноклеточным раком. Из-за гистологической неоднородности лечить рак легкого крайне сложно.
На основании последних данных и понимания генетической основы рака легкого в качестве терапевтических мишеней используются EGFR, K-ras, ALK, MET, CBL и COX2. На основании этих мишеней в исследованиях продемонстрировано использование кризотиниба при лечении НМРЛ. Кризотиниб является ингибитором киназы анапластической лимфомы (ALK).
Эффективность эрлотиниба при лечении рака легкого с мутациями EGFR доказана в исследовании FLEX. Данные гистопатологического исследования и анамнеза больного также учитываются при оценке состояния заболевания и его агрессивности.
Ф. Найберг с соавторами, изучали связь между полиморфизмом олигонулеотидов и острым интерстициальным заболеванием легких у японцев, получающих лечение гефитинибом. Это исследование послужило основой для дальнейших исследований.
Обнаружено, что в китайской популяции полиморфизм ABCC1 связан с предрасположенностью к развитию рака легких у пациентов, проходящих химиотерапию.
Геномные вариации EGFR и ERCC1 также коррелируют с ответом на лекарственную противоопухолевую терапию у пациентов мелкоклеточным раком легкого.
На основании последних данных и понимания генетической основы рака легкого в качестве терапевтических мишеней используются EGFR, K-ras, ALK, MET, CBL и COX2. На основании этих мишеней в исследованиях продемонстрировано использование кризотиниба при лечении НМРЛ. Кризотиниб является ингибитором киназы анапластической лимфомы (ALK).
Эффективность эрлотиниба при лечении рака легкого с мутациями EGFR доказана в исследовании FLEX. Данные гистопатологического исследования и анамнеза больного также учитываются при оценке состояния заболевания и его агрессивности.
Ф. Найберг с соавторами, изучали связь между полиморфизмом олигонулеотидов и острым интерстициальным заболеванием легких у японцев, получающих лечение гефитинибом. Это исследование послужило основой для дальнейших исследований.
Обнаружено, что в китайской популяции полиморфизм ABCC1 связан с предрасположенностью к развитию рака легких у пациентов, проходящих химиотерапию.
Геномные вариации EGFR и ERCC1 также коррелируют с ответом на лекарственную противоопухолевую терапию у пациентов мелкоклеточным раком легкого.
В 2017 г. FDA также одобрило несколько новых иммунотерапевтических препаратов, направленных против лиганда рецептора программируемой клеточной гибели 1 (PD-L1) Т-лимфоцитов или рецептора запрограммированной клеточной смерти-1 (PD-1).
В отличие от терапии CAR Т-клетками, терапия ингибиторами контрольных точек иммунного ответа (PD-L1/PD-1) нацелена на эндогенный белок или рецептор PD-1, который представляет собой рецептор клеточной поверхности суперсемейства иммуноглобулинов экспрессируемых на Т-клетках и про-В-клетках.
PD-1 связывает два лиганда, PD-L1 и PD-L2. Доказано, что PD-1 и его лиганды ослабляют иммунные реакции, что может помешать иммунной системе девитализировать злокачественные клетки.
Ингибиторы PD-1 и PD-L1 разрабатываются в качестве препаратов первой линии против нескольких типов рака, включая метастатическую меланому, НМРЛ, почечно-клеточный рак, рак мочевого пузыря и лимфома Ходжкина.
В отличие от терапии CAR Т-клетками, терапия ингибиторами контрольных точек иммунного ответа (PD-L1/PD-1) нацелена на эндогенный белок или рецептор PD-1, который представляет собой рецептор клеточной поверхности суперсемейства иммуноглобулинов экспрессируемых на Т-клетках и про-В-клетках.
PD-1 связывает два лиганда, PD-L1 и PD-L2. Доказано, что PD-1 и его лиганды ослабляют иммунные реакции, что может помешать иммунной системе девитализировать злокачественные клетки.
Ингибиторы PD-1 и PD-L1 разрабатываются в качестве препаратов первой линии против нескольких типов рака, включая метастатическую меланому, НМРЛ, почечно-клеточный рак, рак мочевого пузыря и лимфома Ходжкина.
- Chapman P.B., Hauschild A., Robert C. Improved survival with vemurafenib in melaNoma with BRAF V600E mutation // N Engl J Med. 2011. 364: 2507–2516.
- Tsai J., Lee J.T., Wang W. Discovery of a Selective inhibitor of oncogenic B-Raf kinase with potent antimelanoma activity // Proc Natl Acad Sci USA. 2008. 105: 3041-3046.
Goldenberg M.M. Trastuzumab, a recombinant DNA-derived humanized monoclonal antibody, a Novel agent for the treatment of metastatic breast Cancer // Clin Ther. 1999. 21: 309–318.
- Piccart-Gebhart M.J., Procter M., Leyland-Jones B. et al. Trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer // N Engl J Med. 2005;353:1659-72. DOI: 10.1056/NEJMoa052306
- Romond E.H., Perez E.A., Bryant J. et al. Trastuzumab plus adjuvant chemotherapy for operable HER2-positive breast cancer // N Engl J Med 2005;353:1673-84. DOI: 10.1056/NEJMoa052122 -
- Perez E.A., Romond E.H., Suman V.J. et al. Four-year follow-up of trastuzumab plus adjuvant chemotherapy for operable human epidermal growth factor receptor 2-positive breast cancer: joint analysis of data from NCCTG N9831 and NSABP B-31 // J Clin Oncol 2011;29:3366-73. DOI: 10.1200/JCO.2011.35.0868
- Slamon D., Eiermann W., Robert N. et al. Adjuvant trastuzumab in HER2-positive breast cancer // N Engl J Med 2011;365:1273-83. DOI: 10.1056/NEJMoa0910383
- Untch M., Gelber R.D., Jackisch C. et al. Estimating the magnitude of trastuzumab effects within patient subgroups in the HERA trial // Ann Oncol. 2008;19:1090-6. DOI: 10.1093/annonc/mdn005
Wheeler D.L., Dunn E.F., Harari P.M. Understanding resistance to EGFR inhibitors-impact on future treatment strategies // Nat Rev Clin Oncol. 2010. 7: 493–507.
Karapetis C.S., Khambata F.S., Jonker D.J. K-ras mutations and benefit from cetuximab in advanced colorectal cancer // N Engl J Med. 2008. 359: 1757–1765.
Fearon E.R. Molecular genetics of colorectal cancer // Annu Rev Pathol. 2011. 6: 479–507.
Salgia R., Hensing T., Campbell N. et al. Personalized treatment of lung cancer // Semin Oncol. 2011. 38: 74–83.
Curran M.P. Crizotinib: in locally advanced or metastatic non-small cell lung cancer // Drugs. 2012. 72(1): 99–107.
- Ou S.H. Crizotinib: a novel and first-in-class multitargeting tyrosine kinase inhibitor for the treatment of anaplastic lymphoma kinase rearranged non-small cell lung cancer and beyond // Drug Des Devel Ther. 2011. 5: 471–485.
- Shaw A.T., Solomon B., Kenudson M.M. Crizotinib and testing for ALK // J Natl Compr Netw. 2011. 9: 1335–1341.
O’Byrne K.J., Gatzemeir U., Bondarenko I. et al. Molecular biomarkers in non-small cell lung cancer: a retrospective analysis of data from the phase III FLEX study // Lancet Oncol. 2011. 12: 795–805.
Nyberg F., Barratt B.J., Mushiroda T. et al. Interstitial lung disease in gefitinib treated Japanese patients with non-small cell lung cancer: genome-wide analysis of genetic data // Pharmacogenomics. 2011. 12: 965–977.
Yin J.Y., Han L.F., Huang Q. et al. ABCC1 polymorphism Arg723Gln (2168G - A) is associated with lung cancer susceptibility in a Chinese population // Clin Exp Pharmaco Physiol. 2011. 38:632–637.
- Wu J.Y., Shih J.Y., Chen K.Y. et al. Gefitinib therapy in patients with advanced non-small cell lung cancer with or without testing for epidermal growth factor receptor (EGFR) mutations // Medicine. 2011. 90: 159–167.
- Osawa K. SNPsin ERCC1 and drug response to cisplatin in non-small cell lung cancer patients // Pharmacogenomics. 2011. 12: 445–447.
Rizvi N. A. et al. Cancer immunology. Mutational landscape determines sensitivity to PD-1 blockade in non-small cell lung cancer // Science. 2015. 348, 124–128.
Iwai Y., Hamanishi J., Chamoto K., Honjo T. Cancer immunotherapies targeting the PD-1 signaling pathway // J. Biomed. Sci. (2017). 24, 26.
- Alsaab H.O. et al. PD-1 and PD-L1 checkpoint signaling inhibition for cancer immunotherapy: mechanism, combinations, and clinical outcome // Front. Pharmacol. 2017. 8, 561.
- Sunshine J., Taube J.M. PD-1/PD-L1 inhibitors // Curr. Opin. Pharmacol. 2015. 23, 32–38.
Прогнозирование ответа на терапию на основе статуса генной мутации позволяет проводить индивидуализированную терапию и имеет потенциальную экономическую выгоду за счет снижения непомерно высоких затрат на лечение. Таргетная терапия стоит дорого и нельзя недооценивать стоимость персонализированной медицины, особенно в эпоху существенной бюджетной экономии. Персонализированная медицина обеспечивает перспективу экономической выгоды для пациентов за счет ограничения расходов там, где это наиболее рентабельно, за счет того, что лекарства направляются туда, где они будут наиболее эффективными и наименее токсичными. Таким образом, затраты на лечение и осложнения могут быть уменьшены.
По мере того, как персонализированная медицина становится все более популярной и распространенной, лечение больных становится эффективнее. При использовании персонализированного лечения должно использоваться большее количество тестов, что в краткосрочной перспективе может дорого обходиться здравоохранению и страховым компаниям, но при долгосрочном планировании использование персонализированных методик будет выгодным, поскольку будет возможность более ранней диагностики заболевания, его рецидивов и прогрессирования.
Сейчас для принятия решения о лечении онколог должен взвесить не только возраст, состояние здоровья, образ жизни и цели каждого пациента, но и оценить гены и биологию злокачественного новообразования. Правительство должно играть активную роль в быстром утверждении персонализированных медицинских тестов и создавать стимулы для их использования.
По мере того, как персонализированная медицина становится все более популярной и распространенной, лечение больных становится эффективнее. При использовании персонализированного лечения должно использоваться большее количество тестов, что в краткосрочной перспективе может дорого обходиться здравоохранению и страховым компаниям, но при долгосрочном планировании использование персонализированных методик будет выгодным, поскольку будет возможность более ранней диагностики заболевания, его рецидивов и прогрессирования.
Сейчас для принятия решения о лечении онколог должен взвесить не только возраст, состояние здоровья, образ жизни и цели каждого пациента, но и оценить гены и биологию злокачественного новообразования. Правительство должно играть активную роль в быстром утверждении персонализированных медицинских тестов и создавать стимулы для их использования.
- Например, в США в марте 2007 г. Конгрессу был представлен Закон о геномике и персонализированной медицине, охватывающий научные барьеры, неблагоприятное рыночное давление и нормативные препятствия. Благодаря этому, в 2009 г. решено было потратить 19 млрд дол. на модернизацию национальных медицинских информационных технологий и создание электронных медицинских карт, для обеспечения более эффективного и действенного использования данных генетического тестирования и снижения затрат на здравоохранение.
S. 976 (110th): Genomics and Personalized Medicine Act of 2007. URL: https://www.govtrack.us/congress/bills/110/s976
Chanley T. Howell. Stimulus Package Contains $19 Billion for Health Care Technology Spending and Adoption of Electronic Health Records. URL: https://www.foley.com/en/insights/publications/2009/02/stimulus-package-contains-19-billion-for-health-ca
Перечень зарегистрированных в мире ЛП или изделий, которые внедрены и имеют персонализированные показания к применению
Благодаря достижениям в области прецизионной онкологии иммунотерапия была названа в ежегодном отчете ASCO о прогрессе в борьбе со злокачественными новообразованиями «Общественным достижением года». Исследователи годами пытались использовать иммунную систему для лечения рака, но без особого успеха, пока недавно не были обнаружены ингибиторы иммунных контрольных точек (PD-1/PD-L1) и разработана CAR-Т-клеточная терапия.
PD-1/PD-L1
В клинической практике одобрено несколько PD-1 ассоциированных препаратов, включая авелумаб, дурвалумаб и ниволумаб.
- Авелумаб (Бавенсио) представляет собой блокирующее PD-L1 моноклональное антитело для лечения местно-распространенной, метастатической уротелиальной карциномы у пациентов, у которых заболевание не прогрессировало после химиотерапии, содержащей препараты платины и для пациентов метастатической карциномой из клеток Меркеля, в возрасте 12 лет и старше.
- Дурвалумаб (Имфинзи) получил ускоренное одобрение в мире для лечения нерезектабельного местно-распространенного немелкоклеточного рака легкого у взрослых пациентов, не прогрессирующих после химиолучевой терапии на основе препаратов платины.
- Ниволумаб (Опдиво), моноклональное антитело к PD-1 для адъювантного лечения пациентов с метастазами меланомы в лимфатические узлы или пациентов с метастатической меланомой, перенесших радикальную резекцию. Первоначально ниволумаб был одобрен для лечения пациентов с нерезектабельной или метастатической меланомой.
- Пембролизумаб (Кейтруда) одобрен для лечения классической лимфомы Ходжкина (ХЛ) у взрослых и детей с рефрактерной ХЛ или у пациентов с рецидивом после трех или более предыдущих линий лечения. Также препарат одобрен в качестве комбинированной терапии первой линии с пеметрекседом и карбоплатином для пациентов с метастатическим неплоскоклеточным НМРЛ, независимо от экспрессии PD-L1, местно-распространенной или метастатической уротелиальной карциномой, которые прогрессировали после лечения препаратами, содержащими платину.
CAR-Т-клеточная терапия
В августе 2017 г. FDA одобрило первую адоптивную клеточную иммунотерапию (т. е. CAR-Т-клеточную терапию) и первую генную терапию рака – Тисагенлеклейсел. Раковые клетки разработали защиту для уклонения от обнаружения и уничтожения их иммунными клетками. Т-клеточная терапия химерным антигенным рецептором (CAR) – это тип адоптивной клеточной иммунотерапии, при котором собственные иммунные клетки пациента генетически перепрограммируются для обнаружения и уничтожения раковых клеток по всему телу. - -
- Тисагенлеклейсел (Tisagenlecleucel (Kymriah)) представляет собой генетически модифицированную аутологичную Т-клеточную иммунотерапию или CAR Т-клеточную терапию, направленную против антигенов кластера дифференцировки 19 (CD19) при В-клеточном остром лимфобластном лейкозе (ОЛЛ). CD19 расположен на поверхности В-линейных клеток, и, когда он связывается с рецептором антигена на В-лимфоцитах, снижает уровень активации, зависимой от рецептора антигена.
Конъюгаты антитело-лекарственные средства
Конъюгаты антитело-лекарственное средство (ADC) были разработаны как сильнодействующие таргетные препараты против различных видов рака. Назначение этих препаратов состоит в том, чтобы щадить нормальные клетки, в то же время целенаправленно воздействовать на злокачественные клетки.
Эти сложные молекулы состоят из цитотоксического противоракового препарата, связанного с антителом, которое специфически и идеально нацелено на белковый онкомаркер, обнаруженный только на раковых клетках. Антитело прикрепляется к белку-мишени на поверхности раковой клетки, что вызывает клеточный ответ, при котором антитело и лекарство поглощаются раковой клеткой, где лекарство высвобождается, вызывая апоптоз клетки.
Для клинического использования недавно было одобрено три новых ADC: брентуксимаб ведотин, сацитузумаб говитекан и трастузумаб дерукстекан.
Эти сложные молекулы состоят из цитотоксического противоракового препарата, связанного с антителом, которое специфически и идеально нацелено на белковый онкомаркер, обнаруженный только на раковых клетках. Антитело прикрепляется к белку-мишени на поверхности раковой клетки, что вызывает клеточный ответ, при котором антитело и лекарство поглощаются раковой клеткой, где лекарство высвобождается, вызывая апоптоз клетки.
Для клинического использования недавно было одобрено три новых ADC: брентуксимаб ведотин, сацитузумаб говитекан и трастузумаб дерукстекан.
- Брентуксимаб ведотин избирательно воздействует на CD30, который высоко экспрессируется при лимфоме Ходжкина. Этот ADC в настоящее время используется в сочетании с химиотерапией в качестве терапии первой линии у пациентов с прогрессирующей ХЛ. ADC сацитузумаб говитекан нацелен на антиген поверхности клеток трофобласта (Trop-2) и селективно доставляет высокие дозы SN-38, активного метаболита ингибитора топоизомеразы 1, иринотекана. SN-38 в 1000 раз более активен, чем иринотекан. Сацитузумаб говитекан одобрен для интенсивно предлеченных пациентов трижды негативным метастатическим раком молочной железы.
- Трастузумаб дерукстекан одобрен для лечения пациентов с HER2-положительным, местно-распространенным или метастатическим раком молочной железы, получавших лечение трастузумабом (Герцептин), пертузумабом (Перьета) и адо-трастузумабом эмтанзином
Циклин-зависимые киназы CDK4 и CDK6
Циклин-зависимые киназы CDK4 и CDK6 (CDK4/6) обычно не регулируются и чрезмерно активируются во многих типах раковых клеток. Большой интерес был сосредоточен на разработке ингибиторов CDK4/6 для ослабления сигнальных путей роста и восстановления контроля клеточного цикла в раковых клетках. CDK4/6 взаимодействуют с циклином D, который синтезируется в начале G1. Комплекс циклин/CDK управляет продвижением клеточного цикла от G1 к S-фазе. Ингибиторы блокируют эти киназы, чтобы остановить переход клеток из фазы G1 в фазу S.
- В 2017 г. FDA одобрило рибоциклиб (Кискали) в сочетании с ингибитором ароматазы для лечения женщин в постменопаузе с распространенным или метастатическим HER2-отрицательным раком молочной железы, положительным по рецепторам гормонов.
- Впоследствии абемациклиб (Верзенио) был одобрен для использования в комбинации с фулвестрантом, селективным деструктором рецепторов эстрогена (SERD), у аналогичных пациентов, но прогрессироваших после предшествующего лечения.
Фермент PARP
Фермент PARP важен для восстановления одиночных разрывов ДНК, а ингибиторы PARP предотвращают восстановление ДНК, что приводит к гибели клеток. Три ингибитора PARP были одобрены для клинического применения: олапариб, рукапариб и нирапариб.
- Олапариб и рукапариб используются у пациентов с раком яичников с мутацией BRCA, которые ранее получали химиотерапию.
- Нирапариб используется в качестве поддерживающей терапии у пациентов с чувствительным к платине рецидивирующим раком яичников, у которых есть ответ на химиотерапию на основе платины, независимо от статуса BRCA или гомологичной рекомбинации опухоли. Несколько исследований показали эффективность олапариба при раке молочной железы и предстательной железы.
Lyons Y.A., Wu S.Y. Overwijk, W. W. Baggerly, K. A. & Sood, A. K. Immune cell profiling in cancer: molecular approaches to cell-specific identification // npj Pre-cision Oncol. 2017. 1, 26. DOI: 10.1038/s41698-017-0031-0
Shin S.H., Bode A.M., Dong Z. Addressing the challenges of applying precision oncology // npj Precision Oncol. 2017. 1, 28. DOI: 10.1038/s41698-017-0032-z
Chen A. PARP inhibitors: its role in treatment of cancer // Chin J Cancer. 2011 Jul;30(7):463-71. DOI: 10.5732/cjc.011.10111. PMID: 21718592; PMCID: PMC4013421
Эти одобрения являются отражением множества новаторских изменений в лечении рака и готовности онкологов обеспечить более быстрый доступ пациентов к этим жизненно важным методам лечения. В то же время безопасность и нецелевая токсичность, а также развитие резистентности являются основными проблемами, которые необходимо учитывать. Важные вопросы, которые необходимо решить: Почему одни пациенты реагируют, а другие нет? Почему некоторые пациенты сначала реагируют на лечение, но в конечном итоге у них развивается резистентность? Одной из самых больших проблем является идентификация отдельных белков в раковых клетках, на которые можно целенаправленно воздействовать, не нанося вреда нормальным клеткам.
Состояние персонализированной онкологии в России
Несмотря на большое количество проводимых исследований, многие из них находятся в стадии доклинического изучения. Однако представленные результаты имеют высокую потенциальную научную ценность.
- Следует отметить большое количество научно-исследовательских организаций, вовлеченных в проведение исследований в области персонализированной онкологии. Основное направление отечественных исследований в данной сфере связано с разработкой подходов к выбору индивидуального плана лечения при помощи современных методов диагностики.
- В России разработаны подходы к назначению лечения на основе фенотипических и генетических особенностей опухолей с использованием иммунотерапии и таргетных препаратов. Разрабатываются отечественные препараты, в том числе в рамках программ импортозамещения. Разрабатываются решения для выявления молекулярно-генетических особенностей опухоли с помощью методов секвенирования нового поколения – полноэкзомного и полногеномного секвенирования, RNASeq. Развитие данных технологий в онкологии поддерживается из средств федерального бюджета и грантов. Работы по данному направлению согласуются с новейшими зарубежными исследованиями, а результаты исследований находят отражение в современных клинических рекомендациях, руководствах для врачей и монографиях.
- На основе методов секвенирования нового поколения и анализа геномных данных ведутся работы по выявлению молекулярно-генетических предикторов радиочувствительности и радиорезистентности злокачественных новообразований, индивидуальных особенностей метастазирования опухолей.
- В то же время ведутся исследования, посвященные изучению и преодолению лекарственной устойчивости. Такие работы носят фундаментальный характер и составляют перспективную основу для многих других направлений, связанных с разработкой новых методов диагностики и лечения злокачественных новообразований, формированию персонализированных подходов к терапии с учетом индивидуальных генетических особенностей опухоли.
- Ведутся исследования в области применения CAR-T терапии, терапевтических вакцин и онколитических вирусов. Однако их использование в клинической практике единично из-за отсутствия необходимой правовой базы и доступных препаратов. Для дальнейшей оценки возможной эффективности данных методов необходимо проведение экспериментов на животных и клинических исследований.
- Развивающимся направлением диагностики и выявления индивидуальных особенностей опухолей является определение циркулирующих кольцевых ДНК, нуклеиновых кислот, ДНК аптамеров в биологических жидкостях. Однако возможность применения данных технологий требует оценки в рамках клинических исследований
- Использование тераностических возможностей является перспективным для развития прецизионной онкологии. Ведутся исследования в области радиологии, посвященные возможности лечебно-диагностического применения радиофармпрепаратов, но в России подобные исследования находятся на начальном уровне.
- Важным компонентом ПМ является разработка систем помощи принятия врачебных решений, применение систем искусственного интеллекта и машинного обучения для обработки медицинских данных и формирования индивидуального прогноза в клинической практике. В отечественной онкологии применение подобных систем находится на начальном уровне. В настоящее время ведущими научными учреждениями созданы программы для ЭВМ, разрабатываются способы их практического применения. Разработка и внедрение подобных систем является компонентом цифровизации здравоохранения и может способствовать повышению качества медицинской помощи.
- Перспективы развития персонализированной онкологии связаны с внедрением технологий диагностики на основе анализа омиксных данных – исследования протеома и метаболома опухоли. Данное направление активно развивается в России и мире, однако анализ омиксных данных требует применения дорогостоящего оборудования, разработки технологических решений для внедрения в практику, что может явиться ограничением для развития омиксных технологий в России.
Таким образом, в рамках прецизионной онкологии возможно внедрение новых методов диагностики и лечения онкологических заболеваний. В настоящее время наиболее широко исследуются способы применения иммуно- и таргетной терапии в зависимости от молекулярно-генетических и фенотипических особенностей опухоли.
В России активно развиваются геномные технологии, что способствует повышению качества диагностики. Для дальнейшего развития отрасли необходима разработка новых таргетных препаратов, в том числе с использованием импортозамещающих технологий.
Перспективными разделами прецизионной онкологии является применение CAR-T терапии, терапевтических вакцин и онколитических вирусов, омиксных технологий и систем искусственного интеллекта, однако их развитие в России требует дополнительных инвестиций.
Опубликованы свидетельства о регистрации программ для ЭВМ, предназначенных для прогнозирования развития клинических состояний, однако разработка способов их клинического применения находится на начальном уровне.
В России активно развиваются геномные технологии, что способствует повышению качества диагностики. Для дальнейшего развития отрасли необходима разработка новых таргетных препаратов, в том числе с использованием импортозамещающих технологий.
Перспективными разделами прецизионной онкологии является применение CAR-T терапии, терапевтических вакцин и онколитических вирусов, омиксных технологий и систем искусственного интеллекта, однако их развитие в России требует дополнительных инвестиций.
Опубликованы свидетельства о регистрации программ для ЭВМ, предназначенных для прогнозирования развития клинических состояний, однако разработка способов их клинического применения находится на начальном уровне.
Предложения по перспективному планированию:
- Объединить усилия университетов и исследовательских центров по разработке персонализированных подходов в диагностике, лечении и профилактике онкологических заболеваний с привлечением финансовых ресурсов (грантов, государственных программ).
- Развитие и клиническая валидация CAR-T терапии, терапевтических вакцин и онколитических вирусов с привлечением ведущих специалистов в области биотехнологии и разработки вакцин, лекарственного лечения онкологических заболеваний.
- Разработка и клиническая валидация новых таргетных лекарственных препаратов, в том числе с привлечением импортозамещающих технологий на базе ведущих профильных центров с привлечением фармкомпаний.
- Развитие и внедрение в клиническую практику геномных и информационных технологий, позволяющих формировать индивидуальный прогноз и план лечения пациента, в том числе на основе генетических и фенотипических особенностей опухоли. Разработка подходов к применению омиксных технологий для диагностики и выбора тактики лечения онкологических заболеваний. Применение технологий изучения и редактирования генома, обработки клинических данных с использованием систем искусственного интеллекта позволит повысить эффективность лечения онкологических больных.
- Создание новых и совершенствование существующих образовательных программ по прецизионной онкологии, подготовка квалифицированных кадров, стажировка и повышение квалификации сотрудников, привлечение и закрепление ведущих ученых и перспективных молодых специалистов в области персонифицированной медицины. Включение в программы подготовки врачей-онкологов изучение персонализированного подхода в онкологии. Проведение профильных научно-практических конференций, симпозиумов и круглых столов.
Болезни системы кровообращения
Основные направления мировых исследований
Актуальность исследований по ПМ, проводимых по направлению «Болезни системы кровообращения» (БСК), определяют: большая гетерогенность популяции кардиологических пациентов, многофакторная этиология, сложные патогенетические механизмы развития и прогрессирования патологии, присутствие высокой коморбидности и острая потребность в персонализации терапии на фоне роста числа медикаментозных и немедикаментозных методов лечения.
В аспекте персонализированных подходов к оказанию медицинской помощи при БСК определяются несколько направлений, включающих:
В аспекте персонализированных подходов к оказанию медицинской помощи при БСК определяются несколько направлений, включающих:
- оценку индивидуального риска развития и прогрессирования заболеваний БСК на основе идентификации молекулярно-генетических маркеров и других биомаркеров;
- применение персонализированных методов лечения заболеваний и коррекции состояний, в том числе персонализированное применение лекарственных препаратов, основанное на анализе генетических особенностей и биомаркеров;
- использование биомаркеров для мониторинга эффективности лечения и оценки прогноза пациента;
- персонализированные информационные технологи в медицине с использованием вычислительных инструментов и искусственного интеллекта.
Основные достижения персонализированной медицины в БСК и примеры успешной реализации в мире
Учитывая гетерогенность заболеваний в структуре БСК, успех и перспективы ПМ крайне различаются, в зависимости от вклада генетического компонента в патогенез заболевания.
Наследственные и генетически-обусловленные заболевания в кардиологии являются той группой патологий, в отношении которой, наверное, в наибольшей степени стало актуально применение принципов персонифицированного подхода. Это произошло благодаря появлению новых прорывных технологий секвенирования генома и разработке сложных алгоритмов биоинформатического анализа, построенных на обработке Big Data, что в совокупности позволило приблизить к реальной клинической практике применение знаний относительно генетической природы наследственных заболеваний сердца.
При этом речь идет не только о выделении конкретного генетического дефекта и сигнального пути, участвующего в развитии болезни, но и о выяснении путей модуляции активности белков – участников данного сигнального пути и, соответственно, определении новых терапевтических подходов.
Наследственные и генетически-обусловленные заболевания в кардиологии являются той группой патологий, в отношении которой, наверное, в наибольшей степени стало актуально применение принципов персонифицированного подхода. Это произошло благодаря появлению новых прорывных технологий секвенирования генома и разработке сложных алгоритмов биоинформатического анализа, построенных на обработке Big Data, что в совокупности позволило приблизить к реальной клинической практике применение знаний относительно генетической природы наследственных заболеваний сердца.
При этом речь идет не только о выделении конкретного генетического дефекта и сигнального пути, участвующего в развитии болезни, но и о выяснении путей модуляции активности белков – участников данного сигнального пути и, соответственно, определении новых терапевтических подходов.
К перспективным с точки зрения разработки таргетной терапии механизмам развития заболевания относится чрезмерная вовлеченность миозина в сократительную активность при гипертрофической кардиомиопатии (ГКМП) – в нормальном миокарде в покое вовлечено около 10 % молекул миозина, при наличии саркомерных мутаций – основной причины заболевания, их количество резко возрастает, что и приводит к гипертрофии миокарда. Ингибирование миозина оказалось эффективным лечебным воздействием, уменьшающим степень гипертрофии и обструкции выносящего тракта левого желудочка сердца. Патологическая гипертрофия при так называемых фенокопиях ГКМП развивается совершенно иначе.
Расопатии – группа наследственных заболеваний, проявляющихся в детском возрасте и являющихся следствием нарушений в сигнальном пути Ras/MARK, при которых, кроме выраженной гипертрофии миокарда (чаще бивентрикулярной), у больных фиксируются признаки дисэмбриогенеза. При редком рецессивном гликогенозе 2-го типа (болезнь Помпе) увеличение толщины стенки миокарда развивается за счет накопления гликогена вследствие дефекта гена GAA. Похожим образом развивается гипертрофия миокарда при другой болезни накопления – болезни Данона, связанной с дефектом гена LAMP2, кодирующего одноименный лизосомальный фермент. Все эти сведения активно исследуются в отношении разработки таргетного лечения.
Выявление патологической гипертрофии миокарда во многих случаях требует постановки генетического диагноза для выявления заболеваний, имеющих специфическое лечение (болезнь Данона, Фабри, амилоидоз и т.д.). С точки зрения прогнозирования течения болезни с использованием омиксных технологий до настоящего времени не получено результатов, готовых к внедрению в клинику, однако подобные исследования активно проводятся.
Перспективным направлением представляется профилирование микроРНК больных ГКМП, позволяющее выявить дефектные гены, ответственные за развитие заболевания. Эти данные могут позволить разработать недорогой способ выявления дефектных генов.
Расопатии – группа наследственных заболеваний, проявляющихся в детском возрасте и являющихся следствием нарушений в сигнальном пути Ras/MARK, при которых, кроме выраженной гипертрофии миокарда (чаще бивентрикулярной), у больных фиксируются признаки дисэмбриогенеза. При редком рецессивном гликогенозе 2-го типа (болезнь Помпе) увеличение толщины стенки миокарда развивается за счет накопления гликогена вследствие дефекта гена GAA. Похожим образом развивается гипертрофия миокарда при другой болезни накопления – болезни Данона, связанной с дефектом гена LAMP2, кодирующего одноименный лизосомальный фермент. Все эти сведения активно исследуются в отношении разработки таргетного лечения.
Выявление патологической гипертрофии миокарда во многих случаях требует постановки генетического диагноза для выявления заболеваний, имеющих специфическое лечение (болезнь Данона, Фабри, амилоидоз и т.д.). С точки зрения прогнозирования течения болезни с использованием омиксных технологий до настоящего времени не получено результатов, готовых к внедрению в клинику, однако подобные исследования активно проводятся.
Перспективным направлением представляется профилирование микроРНК больных ГКМП, позволяющее выявить дефектные гены, ответственные за развитие заболевания. Эти данные могут позволить разработать недорогой способ выявления дефектных генов.
Попытка воздействия на аналогичный с ГКМП миозиновый механизм не увенчалась клиническим успехом при дилатационной кардиомиопатии (ДКМП). Дальнейшие поиски выявили, что ДКМП сопровождается интенсивным апоптозом (развивающаяся вследствие дефекта гена LMNA, вторая по частоте генетически обусловленная форма заболевания, составляющая примерно 8 % случаев).
В исследованиях на животных обнаружили, что потеря функции ламина А/С из-за его генетического дефекта активирует путь митоген-активируемой протеинкиназы p38 (MAPK). Активация пути p38 MAPK также была продемонстрирована при исследовании биоптатов сердца взрослых пациентов с ДКМП, связанной с патогенными вариантами гена LMNA. Активация этого пути ведет к усилению апоптоза кардиомиоцитов, их гипертрофии, снижению сократительной способности миокарда.
Обнаружение при ДКМП носительства патогенных вариантов генов ламина А/С, фосфоламбана, десмоплакина и филамина С свидетельствует о наличии высокого риска внезапной смерти и стало отдельным показанием для имплантации кардиовертера – дефибриллятора вне зависимости от фракции выброса.
В исследованиях на животных обнаружили, что потеря функции ламина А/С из-за его генетического дефекта активирует путь митоген-активируемой протеинкиназы p38 (MAPK). Активация пути p38 MAPK также была продемонстрирована при исследовании биоптатов сердца взрослых пациентов с ДКМП, связанной с патогенными вариантами гена LMNA. Активация этого пути ведет к усилению апоптоза кардиомиоцитов, их гипертрофии, снижению сократительной способности миокарда.
Обнаружение при ДКМП носительства патогенных вариантов генов ламина А/С, фосфоламбана, десмоплакина и филамина С свидетельствует о наличии высокого риска внезапной смерти и стало отдельным показанием для имплантации кардиовертера – дефибриллятора вне зависимости от фракции выброса.
Изучение механизмов развития легочной артериальной гипертензии вывило несколько звеньев, которые в настоящее время являются объектом интенсивного изучения.
Ключевой механизм – активация пролиферации за счет угнетения сигнальных путей, препятствующих ее развитию (опосредованные через рецептор 2-го типа костного морфогенетического белка), а также их регуляция с помощью эстрогенов. Описаны многочисленные патогенные варианты генов белков, кодирующих эти сигнальные пути и приводящих к выраженному дисбалансу в пользу существенной активации пролиферации. Модуляция сигнального пути костных морфогенетических пептидов тирозинкиназного пути исследуются как потенциальные цели лечения ЛАГ.
Включение в обследование больного омиксных технологий дает возможность в ряде случаев устанавливать точный диагноз или существенно улучшить качество прогностических моделей, способных изменить тактику ведения больного.
Омиксные технологии при разработке плана ведения больного ЛАГ в настоящее время практически не используются. Исключение составляет использование генотипирования для постановки диагноза венооклюзионной болезни легких, имеющей мало клинических отличий от идиопатической ЛАГ, но обладающей существенно худшим прогнозом и высокой вероятностью потенциально фатальных осложнений при применении стандартной ЛАГ-специфической терапии. Появление «прорывных» данных, вероятно, будет связано с уточнением регуляторных механизмов, причастных к развитию заболевания.
Ключевой механизм – активация пролиферации за счет угнетения сигнальных путей, препятствующих ее развитию (опосредованные через рецептор 2-го типа костного морфогенетического белка), а также их регуляция с помощью эстрогенов. Описаны многочисленные патогенные варианты генов белков, кодирующих эти сигнальные пути и приводящих к выраженному дисбалансу в пользу существенной активации пролиферации. Модуляция сигнального пути костных морфогенетических пептидов тирозинкиназного пути исследуются как потенциальные цели лечения ЛАГ.
Включение в обследование больного омиксных технологий дает возможность в ряде случаев устанавливать точный диагноз или существенно улучшить качество прогностических моделей, способных изменить тактику ведения больного.
Омиксные технологии при разработке плана ведения больного ЛАГ в настоящее время практически не используются. Исключение составляет использование генотипирования для постановки диагноза венооклюзионной болезни легких, имеющей мало клинических отличий от идиопатической ЛАГ, но обладающей существенно худшим прогнозом и высокой вероятностью потенциально фатальных осложнений при применении стандартной ЛАГ-специфической терапии. Появление «прорывных» данных, вероятно, будет связано с уточнением регуляторных механизмов, причастных к развитию заболевания.
Высокий риск у больных с LQTS 1-го типа обнаруживается у гомозиготных и компаунд-гетерозиготных носителей патогенных вариантов гена KCNQ1. Для больных высокого риска при LQTS2 характерно расположение патогенного варианта в области, кодирующей пору канала KCNH2, при LQTS3 – в области поры и трансмембранных доменов в SCN5A.
Кроме того, учитывая существенные различия в ведении больных с разными типами LQTS, генотипирование приобретает принципиальное значение для разработки персонализированного подхода.
Кроме того, учитывая существенные различия в ведении больных с разными типами LQTS, генотипирование приобретает принципиальное значение для разработки персонализированного подхода.
Кальциноз клапанов сердца – одна из распространенных причин развития приобретенных пороков сердца. Несмотря на снижение смертности из-за расширения объема хирургических и транскатетерных вмешательств,бремя приобретенных пороков, связанных с кальцификации клапанов, остается по-прежнему значительным.
По мнению большинства экспертов доля пациентов, которые будут нуждаться в хирургическом лечении, возрастет к 2050 г. как минимум в два раза. Notch сигналинговый путь рассматривается в качестве основного регулятора процессов кальцификации клапанов сердца. Предпринятые в настоящее время в мире попытки обосновать применение ингибиторов ГМГ-КоА-редуктазы, витамина К, ингибитора RANKL препарата деносумаба для сдерживания темпов прогрессирования аортального стеноза не подтвердили свою эффективность в реальной клинической практике. Поэтому дальнейшие исследования Notch сигналинга как потенциальной мишени для терапевтического воздействия представляется чрезвычайно актуальным.
По мнению большинства экспертов доля пациентов, которые будут нуждаться в хирургическом лечении, возрастет к 2050 г. как минимум в два раза. Notch сигналинговый путь рассматривается в качестве основного регулятора процессов кальцификации клапанов сердца. Предпринятые в настоящее время в мире попытки обосновать применение ингибиторов ГМГ-КоА-редуктазы, витамина К, ингибитора RANKL препарата деносумаба для сдерживания темпов прогрессирования аортального стеноза не подтвердили свою эффективность в реальной клинической практике. Поэтому дальнейшие исследования Notch сигналинга как потенциальной мишени для терапевтического воздействия представляется чрезвычайно актуальным.
Миокардиты и перикардиты – широко распространенная в общей популяции населения патология сердца, которая вызывает большие трудности у практикующих врачей как в диагностике, так и в лечении из-за отсутствия четких представлений о патогенезе заболеваний и в связи с особенностями верификации диагноза.
Исследования последних лет демонстрируют, что развитие воспалительных заболеваний миокарда и перикарда должны рассматриваться не только с позиции нарушений приобретенного, но и врожденного иммунитетов. По мнению большинства исследователей, инфламмасома NLRP3 не только запускает созревание провоспалительных цитокинов (интерлейкина-1β и -18) для инициации воспалительной реакции, но и играет ключевую роль в модуляции хронического воспаления, нарушая физиологическую адаптацию кардиомиоцитов и приводя к прогрессированию сердечной недостаточности.
Исследования в области врожденного иммунитета и его роли в патогенезе воспалительных заболеваний миокарда и перикарда открывает новые возможности для обоснования терапии блокаторами интерлейкина-1 и ингибиторами янус-киназы, а также для разработки нового класса препаратов – ингибиторов инфламмасом.
Исследования последних лет демонстрируют, что развитие воспалительных заболеваний миокарда и перикарда должны рассматриваться не только с позиции нарушений приобретенного, но и врожденного иммунитетов. По мнению большинства исследователей, инфламмасома NLRP3 не только запускает созревание провоспалительных цитокинов (интерлейкина-1β и -18) для инициации воспалительной реакции, но и играет ключевую роль в модуляции хронического воспаления, нарушая физиологическую адаптацию кардиомиоцитов и приводя к прогрессированию сердечной недостаточности.
Исследования в области врожденного иммунитета и его роли в патогенезе воспалительных заболеваний миокарда и перикарда открывает новые возможности для обоснования терапии блокаторами интерлейкина-1 и ингибиторами янус-киназы, а также для разработки нового класса препаратов – ингибиторов инфламмасом.
Исследования последнего десятилетия показали, что при разработке персонализованного подхода к лечению многих заболеваний следует учитывать состояние микробиома кишечника. Его изменения могут лежать в основе более агрессивного течения болезни, пенетрации генетически обусловленной патологии и могут служить одной из целей лечения. Список метаболитов микробиоты кишечника, потенциально модулирующих течение БСК, постоянно пополняется, при этом выделяют потенциально патогенные и протекторные метаболиты.
За последнее десятилетие описано более 300 эндогенных метаболитов кишечных бактерий, включая моноамины, биогенные амины, производные индола, фенолы, витамины, аминокислоты с разветвленной цепью, липиды и т.п. Наиболее активно изучаются короткоцепочечные жирные кислоты, желчные кислоты, которые могут оказывать провоспалительное или противовоспалительное действие в зависимости от типа и концентрации желчных кислот. Также исследуют влияние разного уровня синтеза незаменимых аминокислот (лейцина, изолейцина и валина), триметиламин-N-оксида, липополисахаридов (эндотоксинов). Подходы, которые в настоящее время относят к области прецизионной медицины, основанные на омиксных технологиях, теоретически могут помочь в выявлении конкретных бактериальных штаммов, ассоциированных с конкретной БСК, и разработке индивидуальных планов лечения на их основе.
Развитие ДКМП в исходе миокардита может быть частично связано с тем, что кишечные бактериоиды способны синтезировать пептид, клеточный иммунный ответ на который также комплиментарен к тяжелой цепи миозина 6. Антибактериальная терапия препятствовала прогрессированию ДКМП в эксперименте.
Комплексный геномный (GWAS) и биоинформатический анализ 47 309 случаев сердечной недостаточности и 930 014 контрольных лиц выявил ассоциацию концентрации Шигелл в микробиоте с вероятностью развития хронической сердечной недостаточности (ХСН) и ГКМП.
Одним из возможных путей участия микробиоты кишечника в развитии ЛАГ может быть увеличение поступления в кровь метаболитов, активирующих воспалительные процессы.
За последнее десятилетие описано более 300 эндогенных метаболитов кишечных бактерий, включая моноамины, биогенные амины, производные индола, фенолы, витамины, аминокислоты с разветвленной цепью, липиды и т.п. Наиболее активно изучаются короткоцепочечные жирные кислоты, желчные кислоты, которые могут оказывать провоспалительное или противовоспалительное действие в зависимости от типа и концентрации желчных кислот. Также исследуют влияние разного уровня синтеза незаменимых аминокислот (лейцина, изолейцина и валина), триметиламин-N-оксида, липополисахаридов (эндотоксинов). Подходы, которые в настоящее время относят к области прецизионной медицины, основанные на омиксных технологиях, теоретически могут помочь в выявлении конкретных бактериальных штаммов, ассоциированных с конкретной БСК, и разработке индивидуальных планов лечения на их основе.
Развитие ДКМП в исходе миокардита может быть частично связано с тем, что кишечные бактериоиды способны синтезировать пептид, клеточный иммунный ответ на который также комплиментарен к тяжелой цепи миозина 6. Антибактериальная терапия препятствовала прогрессированию ДКМП в эксперименте.
Комплексный геномный (GWAS) и биоинформатический анализ 47 309 случаев сердечной недостаточности и 930 014 контрольных лиц выявил ассоциацию концентрации Шигелл в микробиоте с вероятностью развития хронической сердечной недостаточности (ХСН) и ГКМП.
Одним из возможных путей участия микробиоты кишечника в развитии ЛАГ может быть увеличение поступления в кровь метаболитов, активирующих воспалительные процессы.
- К ним относится продукт окисления триметиламина (ТМА) – N-оксид триметиламина (ТМАО).
- Более высокая доля кишечных бактерий, продуцирующих ТМА/ТМАО, наблюдалась у больных ЛАГ. К таким продуцентам относятся Clostridium, Desulfovibrio, Enterobacter, Escherichia, Klebsiella, Pseudomonas, Rothia, Prevotella, Clostridium, Staphylococcus, Streptococcus, Anaerostipes rhamnosivorans и Collinsella.
- Еще одним возможным механизмом является увеличение на фоне дисбактериоза проницаемости кишечной стенки и появление в кровотоке бактериального эндотоксина. Среди многочисленных последствий появления этого провоспалительного агента привлекают внимание данные о резком угнетении активности рецептора костного морфогенетического белка 2-го типа в экспериментальной модели с гетерозиготным нокаутом гена BMPR2. Это угнетение сопровождается развитием ЛАГ.
Одним из направлений является изучение возможностей применения уже созданных лекарств с известным действием по новым показаниям. Так, при расопатиях (синдроме Нунан) исследовался ингибитор mTOReverolimus и Ras/MARK trametinib, при легочной артериальной гипертензии исследуется возможность применения препаратов sotatersept, tacralimus, ematinib, tamoxifen, модулирующих описанные вероятные пути патогенеза.
Исследование механизмов регуляции генома привело к разработке РНК-таргетной терапии в двух ключевых направлениях – разработке так называемых антисмысловых олигонуклеотидов и микро РНК.
Существенный прорыв был сделан при разработке аденовирусных векторов доставки генов, обеспечивающих долгосрочную экспрессию трансгенов в генной терапии, причем именно эти векторы оказались наиболее безопасными и эффективными. В эксперименте исследована возможность редактирования с помощью аденовирусного вектора гена RBM20, кодирующего РНК-связывающий белок 20, мутации которого являются частой причиной семейной дилатационной кардиомиопатии (ДКМП).
Анализ исследований последнего десятилетия, использующих омиксные технологии (протеомику, геномику, метаболомику, транскриптомику, микробиомику) демонстрирует их направленность на изучение роли генетических вариаций, биомаркеров и метаболитов в развитии сердечной недостаточности (СН), прогнозировании ее неблагоприятных исходов, а также на отбор пациентов, у которых можно ожидать наилучший ответ на терапию препаратами, применяемыми для лечения СН. При всем многообразии используемой методологии и различиях в дизайне проведенных исследований по персонализированной медицине их авторы сходятся во мнении о необходимости дальнейшей работы в области СН.
Очень перспективными представляются исследования, проводимые в мире по так называемому глубокому фенотипированию, когда при СН осуществляется сетевой анализ биологических данных с комплексным использованием омниксных технологий в дополнение к клиническо-инструментальным и лабораторным характеристикам больных.
В последние годы появился целый ряд новых биомаркеров для оценки сердечно-сосудистых заболеваний, в том числе и при ХСН. Многие из них показали обнадеживающие результаты при прогнозировании развития сердечно-сосудистых заболеваний.
Очень перспективными представляются исследования, проводимые в мире по так называемому глубокому фенотипированию, когда при СН осуществляется сетевой анализ биологических данных с комплексным использованием омниксных технологий в дополнение к клиническо-инструментальным и лабораторным характеристикам больных.
- В качестве примера можно привести программу BIOSTAT-CHF (The BIOlogy Study toTAilored Treatment in Chronic Heart Failure), организованную в 11 европейских странах, в которой анализируются демографические характеристики, биомаркеры, геномные и протеомные параметры у пациентов с СН с низкой фракцией выброса левого желудочка. В рамках этой программы получены новые данные по прецизионному фенотипированию при СН.
В последние годы появился целый ряд новых биомаркеров для оценки сердечно-сосудистых заболеваний, в том числе и при ХСН. Многие из них показали обнадеживающие результаты при прогнозировании развития сердечно-сосудистых заболеваний.
- Так, у пациентов с ХСН BNP и NT-proBNP являются самыми сильными предикторами смертности и госпитализации по поводу ХСН.
- Это прежде всего касается полиморфизма некоторых генов «воспаления» – генов интерлейкинов 4 и 10, промотора гена CD14. Наличие таких противоречивых данных о связи полиморфизма этих и других генов с развитием ХСН можно объяснить национальными особенностями, использованием разных методик определения полиморфизма, неоднородностью обследованных групп по полу, возрасту, наличию или отсутствию факторов риска заболевания. Особое внимание привлекает полиморфизм генов, которые влияют на семейство β-адренорецепторов (β-АР).
Edelberg J.M., Sehnert A.J., Mealiffe M.E. et al. The Impact of Mavacamten on the Pathophysiology of Hypertrophic Cardiomyopathy: A Narrative Review // Am J Cardiovasc Drugs 2022. 22(5):497–510. DOI: 10.1007/s40256-022-00532-x
Monda E., Bakalakos A., Rubino M. et al. Targeted Therapies in Pediatric and Adult Patients With Hypertrophic Heart Disease: From Molecular Pathophysiology to Personalized Medicine // Circ Heart Fail. 2023:e010687. DOI:10.1161/CIRCHEARTFAILURE.123.010687
MacRae C.A., Taylor M.R.G., Mestroni L. et al. Efficacy and Safety of ARRY-371797 in LMNA-Related Dilated Cardiomyopathy: A Phase 2 Study // Circ Genom Precis Med 2023. 16(1):e003730. DOI: 10.1161/CIRCGEN.122.003730
Keen J.L., Al-Naamani N., Ventetuolo C.E. The Future of PAH Treatment // Advances in Pulmonary Hypertension 2023. 22(1):55–61. DOI: 10.21693/1933-088x-22.1.55
Baulina N., Pisklova M., Kiselev I. et al. Circulating miR-499a-5p Is a Potential Biomarker of MYH7-Associated Hypertrophic Cardiomyopathy // Int J Mol Sci. 2022. 23(7). DOI: 10.3390/ijms23073791
Orphanou N., Papatheodorou E., Anastasakis A. Dilated cardiomyopathy in the era of precision medicine: latest concepts and developments // Heart Fail Rev. 2022. 27(4):1173–1191. DOI: 10.1007/s10741-021-10139-0
Neves R., Bains S., Bos J.M. et al. Precision therapy in congenital long QT syndrome // Trends in Cardiovascular Medicine. 2022. DOI: 10.1016/j.tcm.2022.06.006
Dankovtseva E., Osipova N., Minushkina L. et al. Possibilities of molecular biopsy in differential diagnosis of pulmonary arterial hypertension: case description and literature review // Medical news of the North Caucasus. 2018. 13(3). DOI: 10.14300/mnnc.2018.13100
Wang J., Zhang X., Yang X. et al. Revitalizing myocarditis treatment through gut microbiota modulation: unveiling a promising therapeutic avenue // Frontiers in Cellular and Infection Microbiology. 2023, 13. DOI: 10.3389/fcimb.2023.1191936
Luo Q., Hu Y., Chen X. et al. Effects of Gut Microbiota and Metabolites on Heart Failure and Its Risk Factors: A Two-Sample Mendelian Randomization Study // Front Nutr. 2022, 9:899746. DOI: 10.3389/fnut.2022.899746
Huang L., Zhang H., Liu Y., Long Y. The Role of Gut and Airway Microbiota in Pulmonary Arterial Hypertension // Frontiers in Microbiology. 2022, 13. DOI: 10.3389/fmicb.2022.929752
Nakano T.A., Rankin A.W., Annam A. et al. Trametinib for Refractory Chylous Effusions and Systemic Complications in Children with Noonan Syndrome // J Pediatr. 2022, 248:81-88 e81. DOI: 10.1016/j.jpeds.2022.05.030
Au H.K.E., Isalan M., Mielcarek M. Gene Therapy Advances: A Meta-Analysis of AAV Usage in Clinical Settings // Frontiers in Medicine. 2022, 8. DOI: 10.3389/fmed.2021.809118
1
Основные достижения ПМ по артериальной гипертензии
Концепция персонализированной медицины распространяется и на артериальную гипертензию (АГ). Она предполагает стратификацию риска развития АГ и выбор антигипертензивного лечения с учетом индивидуальных особенностей пациента. Так, комплексный учет генетических и фенотипических характеристик, включающих пол, возраст, антропометрические, этнические данные, клинические и физиологические показатели, связанные с профилем артериального давления (АД), поведенческие факторы, а также особенности окружающей среды может существенно улучшить эффективность терапии и снизить риски осложнений.
Динамичное развитие геномных исследований АГ и ассоциированных сердечно-сосудистых заболеваний, а также использование новых аналитических инструментов, открывают многообещающие перспективы замедления роста глобального бремени АГ и ее осложнений. Так, метод менделевской рандомизации раскрывает причинно-следственные связи между клиническими исходами и биомаркерами, которые вскоре могут стать мишенями для лекарств и обеспечить прорыв в лечении АГ. Определенные надежды улучшения профилактики и лечения АГ связывают и с технологией полигеномного секвернирования, которая в сочетании с большими популяционными исследованиями позволила идентифицировать более 1000 генетических локусов, ассоциированных с АГ.
Новейшие методы редактирования генома позволяют корректировать генетические мутации, связанные с АГ и эффективно развивать генную терапию, которая может нейтрализовать негативное влияние генетических факторов на формирование заболевания.
Учитывая многофакторный характер АГ, несомненный потенциал для прогнозирования развития АГ и индивидуализации ее лечения имеет интеграция разных типов данных – клинических, генетических, молекулярных, социально-бытовых (образ жизни, диета, степень физической активности и др.). Обработка этих данных с помощью современных методов аналитики, искусственного интеллекта и машинного обучения, способных учитывать огромное количество данных о характеристиках пациентов и их связь с различными вариантами лечения, позволит строить более точные модели прогнозирования риска и эффективности терапии.
Более сложные подходы к прогнозированию реакции на антигипертензивные препараты поднимают два практических вопроса: Превышает ли польза от прогнозирования этой реакции затраты на сбор и анализ больших объемов данных? Имеет ли данная стратегия смысл с точки зрения заботы об отдельных людях, населении или о том и другом? Ответы зависят от преимуществ использования персонализированной медицины. В связи с этим разумным подходом для персонализированного лечения АГ может быть концепция компромисса между простотой и персонализацией. Так, более персонализированные стратегии лечения могут принести наибольшую пользу пациентам, у которых простые стратегии с низкой информационной нагрузкой оказываются неэффективными. При этом особо высока потребность в разработке новых подходов прогнозирования ответа на антигипертензивные препараты и дорогостоящие инвазивные методы лечения у больных с резистентной АГ, при которой аспекты персонализированной терапии остаются наименее изученным.
К настоящему времени накоплено большое количество информации о полиморфизме генов, связанных с регуляцией АД. Только за последние пять лет понимание генетической основы АГ пришло к полигенным ассоциациям, охватывающим ~30 моногенных редких вариантов и >1,5 тыс. однонуклеотидных вариантов.
Крупномасштабные исследования геномики, в каждом из которых изучалось более 750 000 человек, выявили сотни локусов, связанных с изменениями уровней АД. В крупномасштабном исследовании с проведением полногеномного секвестрирования, включавшем мета-анализ более 900 тыс. участников, был также выявлен ряд связей последовательностей генов с уровнем систолического, диастолического АД и АГ.
Доступны данные о широком профиле биомаркеров. Изучались и отмечены различия у лиц с АГ в составе целого ряда метаболитов.
В оценке эффективности фармакотерапии и выявлении причин ее снижения, а также прогнозировании выраженности ответа на препарат и появления побочных эффектов может помочь фармакометаболомика. В частности, получены данные, касающиеся различий ответа на бета-блокаторы, диуретики и лизиноприл.
Согласно опубликованному в 2023 г. шведскому рандомизированному исследованию обнаружена неоднородность реакции АД на четыре антигипертензивных препарата (лизиноприл, кандесартан, гидрохлоротиазид и амлодипин), которая может иметь существенное значение для персонализированной терапии.
Согласно мета-анализу была документирована ассоциация одного из генетических вариантов с ослаблением реакции АД на β-блокаторы и увеличением риск неблагоприятных сердечно-сосудистых исходов при их использовании.
В настоящее время британскими учеными разрабатывается персонализированный подход к лечению АГ на основе генетического тестирования совместно с определением дополнительных биомаркеров. Однако на текущий момент времени крупномасштабное клиническое лечение АГ на основе генома невозможно из-за потребности в специальной инфраструктуре и малодоступных ресурсах для геномных тестов. Следовательно, персонализированный подход к лечению АГ должен основываться на показателях фенотипа, связанных с особенностями течения заболевания, а также с нервной и гуморальной регуляцией АД. Одним из таких показателей является вариабельность уровней АД, играющая важную роль в прогрессировании сердечно-сосудистых заболеваний и терапии АГ.
Для персонализированной терапии АГ китайскими учеными разработана классификация REASOH, основанная на этиологии АГ и включающая шесть основных ее вариантов: ренин-зависимую гипертензию, гипертензию на основе атеросклероза у пожилых людей, симпатико-активную гипертензию, вторичную гипертензию, солечувствительную гипертензию и гипергомоцистеинемическую гипертензию.
Перспективным направлением персонализированной медицины является развитие искусственного интеллекта, улучшающего процесс принятия клинических решений. Так, в ходе сельского когортного исследования Китайскими учеными было установлено, что оценка полигенного риска с использованием 13 одиночных нуклеотидных полимофизмов в сочетании с учетом традиционных факторов риска значительно улучшала качество модели прогнозирования возникновения АГ.
Также примечательны результаты катарских ученых, согласно которым комбинация полногеномного секвенирования и методики искусственного интеллекта помогла определить уникальный профиль генетической предрасположенности к АГ разных этнических групп.
Важно отметить, что использование искусственного интеллекта для прогнозирования развития АГ на основе факторов риска может быть эффективным даже без анализа генетического материала. Так, ряду научных групп удалось создать модели прогнозирования развития АГ по данным рутинных показателей ежегодных медицинских осмотров, а H.F. Golino с коллегами использовали только антропометрические данные.
На основе данных исследований SPRINT и ACCORD BP с целью персонализации сердечно-сосудистой пользы от интенсивности антигипертензивного лечения американскими учеными была разработана соответствующая программа машинного обучения.
Особенно актуальным персонализированный подход лечения АГ представляется в том случае, когда стандартная стратегия лечения оказывается недостаточно эффективной. Так, выявлен ряд характеристик для отбора пациентов с резистентной АГ для проведения ренальной денервации, позволяющих ожидать наибольшей эффективности лечения. Наиболее распространенным примером искусственного интеллекта для диагностики АГ является суточное мониторирование АД. Однако эта методика сопряжена с рядом неудобств для пациента, а осциллометрический способ измерения АД имеет свои ограничения. В связи с этим в настоящее время предлагается мониторирование АД при помощи более точного и удобного для пациента метода фотоплетизмографии и емкостной технологии.
Динамичное развитие геномных исследований АГ и ассоциированных сердечно-сосудистых заболеваний, а также использование новых аналитических инструментов, открывают многообещающие перспективы замедления роста глобального бремени АГ и ее осложнений. Так, метод менделевской рандомизации раскрывает причинно-следственные связи между клиническими исходами и биомаркерами, которые вскоре могут стать мишенями для лекарств и обеспечить прорыв в лечении АГ. Определенные надежды улучшения профилактики и лечения АГ связывают и с технологией полигеномного секвернирования, которая в сочетании с большими популяционными исследованиями позволила идентифицировать более 1000 генетических локусов, ассоциированных с АГ.
Новейшие методы редактирования генома позволяют корректировать генетические мутации, связанные с АГ и эффективно развивать генную терапию, которая может нейтрализовать негативное влияние генетических факторов на формирование заболевания.
Учитывая многофакторный характер АГ, несомненный потенциал для прогнозирования развития АГ и индивидуализации ее лечения имеет интеграция разных типов данных – клинических, генетических, молекулярных, социально-бытовых (образ жизни, диета, степень физической активности и др.). Обработка этих данных с помощью современных методов аналитики, искусственного интеллекта и машинного обучения, способных учитывать огромное количество данных о характеристиках пациентов и их связь с различными вариантами лечения, позволит строить более точные модели прогнозирования риска и эффективности терапии.
Более сложные подходы к прогнозированию реакции на антигипертензивные препараты поднимают два практических вопроса: Превышает ли польза от прогнозирования этой реакции затраты на сбор и анализ больших объемов данных? Имеет ли данная стратегия смысл с точки зрения заботы об отдельных людях, населении или о том и другом? Ответы зависят от преимуществ использования персонализированной медицины. В связи с этим разумным подходом для персонализированного лечения АГ может быть концепция компромисса между простотой и персонализацией. Так, более персонализированные стратегии лечения могут принести наибольшую пользу пациентам, у которых простые стратегии с низкой информационной нагрузкой оказываются неэффективными. При этом особо высока потребность в разработке новых подходов прогнозирования ответа на антигипертензивные препараты и дорогостоящие инвазивные методы лечения у больных с резистентной АГ, при которой аспекты персонализированной терапии остаются наименее изученным.
К настоящему времени накоплено большое количество информации о полиморфизме генов, связанных с регуляцией АД. Только за последние пять лет понимание генетической основы АГ пришло к полигенным ассоциациям, охватывающим ~30 моногенных редких вариантов и >1,5 тыс. однонуклеотидных вариантов.
Крупномасштабные исследования геномики, в каждом из которых изучалось более 750 000 человек, выявили сотни локусов, связанных с изменениями уровней АД. В крупномасштабном исследовании с проведением полногеномного секвестрирования, включавшем мета-анализ более 900 тыс. участников, был также выявлен ряд связей последовательностей генов с уровнем систолического, диастолического АД и АГ.
Доступны данные о широком профиле биомаркеров. Изучались и отмечены различия у лиц с АГ в составе целого ряда метаболитов.
В оценке эффективности фармакотерапии и выявлении причин ее снижения, а также прогнозировании выраженности ответа на препарат и появления побочных эффектов может помочь фармакометаболомика. В частности, получены данные, касающиеся различий ответа на бета-блокаторы, диуретики и лизиноприл.
Согласно опубликованному в 2023 г. шведскому рандомизированному исследованию обнаружена неоднородность реакции АД на четыре антигипертензивных препарата (лизиноприл, кандесартан, гидрохлоротиазид и амлодипин), которая может иметь существенное значение для персонализированной терапии.
Согласно мета-анализу была документирована ассоциация одного из генетических вариантов с ослаблением реакции АД на β-блокаторы и увеличением риск неблагоприятных сердечно-сосудистых исходов при их использовании.
В настоящее время британскими учеными разрабатывается персонализированный подход к лечению АГ на основе генетического тестирования совместно с определением дополнительных биомаркеров. Однако на текущий момент времени крупномасштабное клиническое лечение АГ на основе генома невозможно из-за потребности в специальной инфраструктуре и малодоступных ресурсах для геномных тестов. Следовательно, персонализированный подход к лечению АГ должен основываться на показателях фенотипа, связанных с особенностями течения заболевания, а также с нервной и гуморальной регуляцией АД. Одним из таких показателей является вариабельность уровней АД, играющая важную роль в прогрессировании сердечно-сосудистых заболеваний и терапии АГ.
Для персонализированной терапии АГ китайскими учеными разработана классификация REASOH, основанная на этиологии АГ и включающая шесть основных ее вариантов: ренин-зависимую гипертензию, гипертензию на основе атеросклероза у пожилых людей, симпатико-активную гипертензию, вторичную гипертензию, солечувствительную гипертензию и гипергомоцистеинемическую гипертензию.
Перспективным направлением персонализированной медицины является развитие искусственного интеллекта, улучшающего процесс принятия клинических решений. Так, в ходе сельского когортного исследования Китайскими учеными было установлено, что оценка полигенного риска с использованием 13 одиночных нуклеотидных полимофизмов в сочетании с учетом традиционных факторов риска значительно улучшала качество модели прогнозирования возникновения АГ.
Также примечательны результаты катарских ученых, согласно которым комбинация полногеномного секвенирования и методики искусственного интеллекта помогла определить уникальный профиль генетической предрасположенности к АГ разных этнических групп.
Важно отметить, что использование искусственного интеллекта для прогнозирования развития АГ на основе факторов риска может быть эффективным даже без анализа генетического материала. Так, ряду научных групп удалось создать модели прогнозирования развития АГ по данным рутинных показателей ежегодных медицинских осмотров, а H.F. Golino с коллегами использовали только антропометрические данные.
На основе данных исследований SPRINT и ACCORD BP с целью персонализации сердечно-сосудистой пользы от интенсивности антигипертензивного лечения американскими учеными была разработана соответствующая программа машинного обучения.
Особенно актуальным персонализированный подход лечения АГ представляется в том случае, когда стандартная стратегия лечения оказывается недостаточно эффективной. Так, выявлен ряд характеристик для отбора пациентов с резистентной АГ для проведения ренальной денервации, позволяющих ожидать наибольшей эффективности лечения. Наиболее распространенным примером искусственного интеллекта для диагностики АГ является суточное мониторирование АД. Однако эта методика сопряжена с рядом неудобств для пациента, а осциллометрический способ измерения АД имеет свои ограничения. В связи с этим в настоящее время предлагается мониторирование АД при помощи более точного и удобного для пациента метода фотоплетизмографии и емкостной технологии.
Rochais F., Vilardaga J.P., Nikolaev V.O. et al. Realtime optical recording of beta1-adrenergic receptor activation reveals supersensitivity of the Arg389 variant to carvedilol // J. Clin. Invest. 2007. Vol. 117. P. 229–235.
Evangelou E., Warren H.R. Genetic analysis of over 1 million people identifies 535 new loci associated with blood pressure traits // Nat Genet. 2018. 50, 1412–1425. DOI: 10.1038/s41588-018-0205-x
Giri A., Hellwege J.N., Keaton J.M. et al. Trans-ethnic association study of blood pressure determinants in over 750,000 individuals // Nat Genet. 2019. 51, 51–62. DOI: 10.1038/s41588-018-0303-9
Giri A., Hellwege J.N., Keaton J.M. et al. Trans-ethnic association study of blood pressure determinants in over 750,000 individuals // Nat Genet. 2019. 51, 51–62. DOI: 10.1038/s41588-018-0303-9
Campbell D., Aman A., Iniesta R. et al. Pharmaco-metabolomics of blood pressure response to beta-blockers and diuretics // J Hypertens. 2018;36:e124-e125. DOI: 10.1097/01
Geng T.T., Jafar T.H. Hypertension Pharmacogenomics in CKD: The Clinical Relevance and Public Health Implications // Kidney 360. 2022. 3, 204–207. DOI: 10.34067/KID.0007792021
Niu M., Wang Y., Zhang L. et al. Identifying the predictive effectiveness of a genetic risk score for incident hypertension using machine learning methods among populations in rural China // Hypertens Res. 2021; 44:1483–1491. DOI: 10.1038/s41440-021-00738-7
Kanegae H., Suzuki K., Fukatani K. et al. Highly precise risk prediction model for new-onset hypertension using artificial intelligence techniques // The Journal of Clinical Hypertension. 2020; 22(3):445-450. DOI: 10.1111/jch.13759
Мaxwell A., Li R., Yang B. et al. Deep learning architectures for multi-label classification of intelligent health risk prediction // BMC Bioinform. 2017;18:523. DOI: 10.1186/s12859-017-1898-z
Мaxwell A., Li R., Yang B. et al. Deep learning architectures for multi-label classification of intelligent health risk prediction // BMC Bioinform. 2017;18:523. DOI: 10.1186/s12859-017-1898-z
Golino H.F., Amaral L.S., Duarte S.F. et al. Predicting increased blood pressure using machine learning// Journal of obesity. 2014. Vol. 2014. DOI: 10.1155/2014/637635
Townsend R.R., Mahfoud F., Kandzari D.E. et al. Catheter-based renal denervation in patients with uncontrolled hypertension in the absence of antihypertensive medications (SPYRAL HTN-OFF MED): a randomised, sham-controlled, proof-of-concept trial // Lancet. 2017;390(10108):2160–70. DOI: 10.1016/s0140-6736(17)32281-x
Kandzari D.E., Bohm M., Mahfoud F. et al. Effect of renal denervation on blood pressure in the presence of antihypertensive drugs: 6-month efficacy and safety results from the SPYRAL HTN-ON MED proof-of-concept randomised trial // Lancet. 2018;391(10137):2346–55. DOI: 10.1016/s0140-6736(18)30951-6
Azizi M., Schmieder R.E., Mahfoud F. et al. Endovascular ultrasound renal denervation to treat hypertension (RADIANCE-HTN SOLO): a multicentre, international, single-blind, randomised, sham-controlled trial // Lancet. 2018;391(10137):2335–45. DOI: 10.1016/s0140-6736(18)31082-1
Kandzari D.E., Bohm M., Mahfoud F. et al. Effect of renal denervation on blood pressure in the presence of antihypertensive drugs: 6-month efficacy and safety results from the SPYRAL HTN-ON MED proof-of-concept randomised trial // Lancet. 2018;391(10137):2346–55. DOI: 10.1016/s0140-6736(18)30951-6
Azizi M., Schmieder R.E., Mahfoud F. et al. Endovascular ultrasound renal denervation to treat hypertension (RADIANCE-HTN SOLO): a multicentre, international, single-blind, randomised, sham-controlled trial // Lancet. 2018;391(10137):2335–45. DOI: 10.1016/s0140-6736(18)31082-1
Nitzan M., Nitzan I. Feasibility of Precision Medicine in Hypertension Management-Scope and Technological Aspects // J Pers Med. 2022;7;12(11):1861. DOI: 10.3390/jpm12111861. PMID: 36573720; PMCID: PMC9698650
Chowdhury M.E.H., Mahbub Z.B., Uddin M.M. et al. Estimating Blood Pressure from the Photoplethysmogram Signal and Demographic Features Using Machine Learning Techniques // Sensors. 2020;20:3127.DOI: 10.3390/s20113127
Chowdhury M.E.H., Mahbub Z.B., Uddin M.M. et al. Estimating Blood Pressure from the Photoplethysmogram Signal and Demographic Features Using Machine Learning Techniques // Sensors. 2020;20:3127.DOI: 10.3390/s20113127
2
Персонификация антитромботической терапии при ишемической болезни сердца
Высококонкурентный рынок антитромботических препаратов в мире сегодня является наиболее динамично развивающимся. По состоянию на 2022 г. он составил 42 млрд дол. США. Ожидается, что к 2029 г. этот показатель практически удвоится и составит 76 млрд дол. США. Рост числа сердечно-сосудистых, онкологических заболеваний, гериатрической популяции и малоподвижный образ жизни определяют динамику развития рынка антитромботических средств.
В аспекте прецессионных подходов к использованию антитромботических препаратов стоит выделить несколько направлений исследований: доказательная медицина как инструмент персонификации; биомаркеры персонификации; фармакогенетические исследования; продвинутые предиктивные модели; системы поддержки принятия решений и технологии искусственного интеллекта.
В аспекте прецессионных подходов к использованию антитромботических препаратов стоит выделить несколько направлений исследований: доказательная медицина как инструмент персонификации; биомаркеры персонификации; фармакогенетические исследования; продвинутые предиктивные модели; системы поддержки принятия решений и технологии искусственного интеллекта.
Доказательная медицина как инструмент персонификации.
Клинические исследования последних лет в области использования антитромботической терапии позволяют вырабатывать более индивидуализированные алгоритмы ведения пациентов. Примером могут служить новые шкалы риска, такие как DAPT, PRECISE-DAPT, позволяющие выделять отдельные группы пациентов, нуждающихся в продлении антитромбоцитарной терапии или, наоборот, ее укорочении.
- Субанализ клинических исследований в аспекте этнических особенностей эффективности и безопасности терапии приводит к появлению новых субпопуляционных алгоритмов по эскалации, деэскалации и продолжительности терапии.
- Сформированы отдельные режимы дозирования антитромботических препаратов в зависимости от массы тела пациента.
- Отдельным направлением последних лет являются исследования гендерных особенностей эффективности и безопасности антитромботических средств с акцентом на женскую популяцию. Это способствует появлению риск-скоринга, учитывающего гендерную характеристику.
Биомаркеры персонификации.
Тестирование функциональной активности тромбоцитов (ФАТ) у пациентов, получающих ингибиторы P2Y12 рецепторов тромбоцитов, стало предметом исследований в последние десятилетия. Сегодня на рынке доступно несколько «открытых» и «закрытых» тест-систем (LTA, VerifyNow, Multiplate, VASP и др.).
Тестирование ФАТ при использовании ацетисалициловой кислоты (АСК) не доказало своей клинической целесообразности и вариабельность в ответе на прием препарата была связана с его биодоступностью и формой выпуска. При этом исследования по персонификации терапии АСК продолжились с использованием других биомаркеров. Так, определение уровня тромбоксана B2 позволяет индивидуализировать дозу АСК.
Субанализ рандомизированных клинических исследований прямых оральных антикоагулянтов, не требующих лабораторного контроля, показал достоверную связь между концентрацией препарата в крови и профилем эффективности/безопасности.
Определение анти-Ха активности для ингибиторов фактора-Xa, «разбавленного» тромбинового времени и экаринового теста для прямых ингибиторов тромбина коррелирует с MS-концентрацией препаратов в крови.
- Доказано, что высокая остаточная активность тромбоцитов по данным ФАТ у пациентов с ОКС после ЧКВ ассоциирована с риском тромбоза стента и крупных сердечно-сосудистых событий (MACE). При этом клиническая целесообразность эскалации антитромбоцитарной терапии на основании тестирования ФАТ не подтвердилась.
- Проведенные исследования имели методологические дефекты или недостаточную статистическую мощность. Есть общее понимание необходимости дальнейших исследований в этом направлении.
- Возможность деэскалации терапии ингибиторами пуриновых рецепторов (c тикагрелора/прасугрела до клопидогрела) с целью минимизации геморрагических рисков была доказана в клинических исследованиях (TOPIC, TROPICAL-ACS и др.). В этом случае тестирование ФАТ доказано в качестве одного из способов деэскалации терапии. Продемонстрирована также возможность снижения дозы прасугрела как вариант деэскалации. Требуется проведение новых исследований.
Тестирование ФАТ при использовании ацетисалициловой кислоты (АСК) не доказало своей клинической целесообразности и вариабельность в ответе на прием препарата была связана с его биодоступностью и формой выпуска. При этом исследования по персонификации терапии АСК продолжились с использованием других биомаркеров. Так, определение уровня тромбоксана B2 позволяет индивидуализировать дозу АСК.
Субанализ рандомизированных клинических исследований прямых оральных антикоагулянтов, не требующих лабораторного контроля, показал достоверную связь между концентрацией препарата в крови и профилем эффективности/безопасности.
Определение анти-Ха активности для ингибиторов фактора-Xa, «разбавленного» тромбинового времени и экаринового теста для прямых ингибиторов тромбина коррелирует с MS-концентрацией препаратов в крови.
- Некоторые категории пациентов (гериатрия, ХБП, экстремальная масса тела и др.) могут получить пользу от персонифицированного подбора дозы препаратов на основании лабораторного мониторинга.
- Отдельные исследования подтверждают эффективность этого подхода. Требуется проведение крупных рандомизированных клинических исследований.
Фармакогенетические исследования.
Существенным преимуществом фармакогенетических исследований перед биомаркерным мониторингом является возможность заблаговременного (до момента инициации терапии) принятия решения о выборе терапии.
Исследования полиморфизма CYP2C9 и VKORC-1 для коррекции дозы варфарина стали первыми, продемонстрировавшими возможности фармакогенетических исследований у пациентов, получающих антитромботические препараты.
Важным вектором фармакогенетических исследований последних лет становятся полигенные ассоциации в исследованиях больших баз данных с использованием технологий полногеномного секвинирования. Так, в исследовании GWAS STUDY была продемонстрирована предикторная роль полиморфизма генов SCOSSP1, CDC42BPA и CTRAC1 в части риска тромбоза коронарного стента и ишемических событий у пациентов, получающих антитромбоцитарные препараты.
Достижения в области фармакогенетических и биомаркерных исследований позволяют ревалидизировать стандартные шкалы тромботического риска и формировать новые предиктивные модели. Так, комбинация клинических данных, данных функциональных исследований, тестирования ФАТ и фармакогенгетической информации позволила сформировать шкалу POPular, персонифицирующую антитромбоцитарную стратегию у пациентов после ЧКВ. Дальнейшие исследования в этой области могут стать основанием для создания ПО-систем поддержки принятия решений при назначении антитромботической терапии наподобие тех, которые уже успешно внедрены для пациентов, получающих терапию антагонистами витамина К (DAWN-AC, INR-STAR, Warfarindosing algorithm и др.).
Антитромботические средства, доступные сегодня на рынке, имеют высокую эффективность, но при этом обладают большой гетерогенностью в части снижения риска тромботических событий и неблагоприятных исходов при разной патологии в различных группах пациентов. Исследования последних лет с использованием технологий искусственного интеллекта позволяют идентифицировать дополнительные генетические факторы, которые до настоящего времени считались «минорными», но могут в совокупности с другими характеристиками (клинические, анамнестические и др.) влиять на резистентность терапии.
Исследования полиморфизма CYP2C9 и VKORC-1 для коррекции дозы варфарина стали первыми, продемонстрировавшими возможности фармакогенетических исследований у пациентов, получающих антитромботические препараты.
- В последующих работах показано, что полиморфизм CYP2C19 у пациентов, получающих клопидогрел, ассоциирован с повышенной частотой неблагоприятных сердечно-сосудистых событий и тромбозов стента.
- Другие гены-кандидаты, кодирующие белки, участвующие в процессе метаболизма и транспорта ингибиторов пуриновых рецепторов, не продемонстрировали такой же мощной корреляции.
- Однако в этой связи перспективным направлением будущих исследований можно считать работы с полигенными предикторами, которые могут персонифицировать терапию в аспекте межлекарственного взаимодействия.
- Было показано, что полиморфизм PPAR и CYP3A4 у пациентов, получающих клопидогрел, не играют существенной роли в метаболизме препарата, но влияют на эффективность при совместном использовании со статинами и фибратами.
Важным вектором фармакогенетических исследований последних лет становятся полигенные ассоциации в исследованиях больших баз данных с использованием технологий полногеномного секвинирования. Так, в исследовании GWAS STUDY была продемонстрирована предикторная роль полиморфизма генов SCOSSP1, CDC42BPA и CTRAC1 в части риска тромбоза коронарного стента и ишемических событий у пациентов, получающих антитромбоцитарные препараты.
Достижения в области фармакогенетических и биомаркерных исследований позволяют ревалидизировать стандартные шкалы тромботического риска и формировать новые предиктивные модели. Так, комбинация клинических данных, данных функциональных исследований, тестирования ФАТ и фармакогенгетической информации позволила сформировать шкалу POPular, персонифицирующую антитромбоцитарную стратегию у пациентов после ЧКВ. Дальнейшие исследования в этой области могут стать основанием для создания ПО-систем поддержки принятия решений при назначении антитромботической терапии наподобие тех, которые уже успешно внедрены для пациентов, получающих терапию антагонистами витамина К (DAWN-AC, INR-STAR, Warfarindosing algorithm и др.).
Антитромботические средства, доступные сегодня на рынке, имеют высокую эффективность, но при этом обладают большой гетерогенностью в части снижения риска тромботических событий и неблагоприятных исходов при разной патологии в различных группах пациентов. Исследования последних лет с использованием технологий искусственного интеллекта позволяют идентифицировать дополнительные генетические факторы, которые до настоящего времени считались «минорными», но могут в совокупности с другими характеристиками (клинические, анамнестические и др.) влиять на резистентность терапии.
- Так, в исследовании Genome-wide Association Study с использованием базы данных однонуклеотидных полиморфизмов (SNPs) удалось выявить 20 SNPs, которые были ассоциированы с девятью белок-кодирующими генами, из которых были выделены пять генов-кандидатов, формировавших «белковую сеть», ассоциированную с экспрессией P2Y12 рецепторов тромбоцитов, являющихся мишенью для антитромбоцитарной терапии.
- Таким образом, технология искусственного интеллекта позволила сформировать профайл пациентов в тайваньской популяции, которые могут иметь отдельные особенности действия антитромботических препаратов. Возможности машинного обучения и искусственного интеллекта станут важнейшим инструментом в исследованиях последующих лет.
Data bridge market research. URL: https://www.databridgemarketresearch.com/reports/global-antithrombotic-drugs-market (дата обращения: 10.02.2023).
Juhani K., William W., Davide C. et al. ESC Guidelines for the diagnosis and management of chronic coronary syndromes: The Task Force for the diagnosis and management of chronic coronary syndromes of the European Society of Cardiology (ESC) // European Heart Journal. 2019. Vol. 41, Iss. 3. P. 407–477.
Gorog D.A., Jeyalan V., Markides R.I.L. et al. Comparison of De-escalation of DAPT intensity or duration in East Asian and Western patients with ACS undergoing PCI: a systematic review and meta-analysis // Thromb Haemost, 2023. Vol. 123. P. 773–792.
Bianca R. Antithrombotic therapy and body mass: an expert position paper of the ESC Working Group on Thrombosis // European Heart Journal. 2018. Vol. 39. Iss. 19. P. 1672–1686.
Maas A., Rosano G., Cifkova R. et al. Cardiovascular health after menopause transition, pregnancy disorders, and other gynaecologic conditions: a consensus document from European cardiologists, gynaecologists, and endocrinologists // European Heart Journal. 2021. Vol. 42(10). P. 967–984.
Levine G.N., Bates E.R., Bittl J.A. et al. ACC/AHA guideline focused update on duration of dual antiplatelet therapy in patients with coronary artery disease: a report of the American College of Cardiology American Heart Association Task Force on Clinical Practice Guidelines // Journal of the American College of Cardiology. 2016. Vol. 68. P. 1082–1115.
Becker D.M., Segal J., Vaidya D. et al. Sex differences in platelet reactivity and response to low-dose aspirin therapy // JAMA. 2006. Vol. 295(12). P. 1420–1427.
Levine G.N., Bates E.R., Bittl J.A. et al. ACC/AHA guideline focused update on duration of dual antiplatelet therapy in patients with coronary artery disease: a report of the American College of Cardiology American Heart Association Task Force on Clinical Practice Guidelines // Journal of the American College of Cardiology. 2016. Vol. 68. P. 1082–1115.
Becker D.M., Segal J., Vaidya D. et al. Sex differences in platelet reactivity and response to low-dose aspirin therapy // JAMA. 2006. Vol. 295(12). P. 1420–1427.
Udaya S.T., Laurent B., Daniel A. et al. Consensus and Update on the Definition of On-Treatment Platelet Reactivity to Adenosine Diphosphate Associated With Ischemia and Bleeding // J Am Coll Cardiol. 2013. Vol. 62 (24). P.2261–2273.
Anastasia A., Albert F. Role of platelet function testing in acute coronary syndromes: a meta-analysis // Open Heart. 2022, Vol. 9(2), e002129.
Mattia G., Dominick J. A.. De-escalation of antiplatelet therapy in acute coronary syndromes: Why, how and when? // Front Cardiovasc Med. 2022. 9: 975969.
Hyo-Soo Kim, Jeehoon Kang et al. Prasugrel-based de-escalation of dual antiplatelet therapy after percutaneous coronary intervention in patients with acute coronary syndrome (HOST-REDUCE-POLYTECH-ACS): an open-label, multicentre, non-inferiority randomised trial // The Lancet. 2020. Vol. 396. Iss. 10257. P. 1079–1089.
Deepak L.Bh., Tilo Gr. et al. Enteric Coating and Aspirin Nonresponsiveness in Patients With Type 2 Diabetes Mellitus // J Am Coll Cardiol. 2017. Vol. 69(6). P. 603–612.
Nischal N.H., Navin M. et al. Personalized allocation of acetylsalicylic acid therapy for secondary prevention of coronary artery disease // Front. Cardiovasc. 2022, Sec. Thrombosis and Haemostasis, Vol. 9.
Paul A. R., Thorsten L. et al. The Effect of Dabigatran Plasma Concentrations and Patient Characteristics on the Frequency of Ischemic Stroke and Major Bleeding in Atrial Fibrillation Patients: The RE-LY Trial (Randomized Evaluation of Long-Term Anticoagulation Therapy) // Journal of the American College of Cardiology. 2014. Vol. 63. Iss. 4. P. 321–328.
Claire D. Laboratory Monitoring of Direct Oral Anticoagulants (DOACs) // Biomedicines. 2021. Vol. 9(5).P. 445.
Tania A., Veronica R. et al. To Measure or Not to Measure: Direct Oral Anticoagulant Laboratory Assay Monitoring in Clinical Practice // Advances in Hematology. 2023, Vol. 2023: 9511499.
Zhitong Li, Xin Wang et al. Atrial cardiomyopathy markers predict ischemic cerebrovascular events independent of atrial fibrillation in patients with acute myocardial infarction // Front. Cardiovasc. Med. 2022, Sec. Coronary Artery Disease, Vol. 9.
Daniel M.F. Claassens, Gerrit J.A. Vos et al. A Genotype-Guided Strategy for Oral P2Y12 Inhibitors in Primary PCI // N Engl J Med. 2019. Vol. 381(17). P. 1621–1631.
Munir Pirmohamed, Girvan Burnside et al. A Randomized Trial of Genotype-Guided Dosing of Warfarin // N Engl J Med. 2013. Vol. 369(24). P. 2294–2303.
Thomas O Bergmeijer, Alfi Yasmina et al. Effect of CYP3A4*22 and PPAR-α Genetic Variants on Platelet Reactivity in Patients Treated with Clopidogrel and Lipid-Lowering Drugs Undergoing Elective Percutaneous Coronary Intervention // Genes (Basel). 2020. Vol. 11(9). P. 1068.
Sri H Kanuri, Rolf P Kreutz. Pharmacogenomics of Novel Direct Oral Anticoagulants: Newly Identified Genes and Genetic Variants // J Pers Med. 2019. Vol. 9(1). P. 7.
Shefali Setia Verma, Thomas O. Bergmeijer Genomewide Association Study of Platelet Reactivity and Cardiovascular Response in Patients Treated With Clopidogrel: A Study by the International Clopidogrel Pharmacogenomics Consortium // Clin Pharmacol Ther. 2020. Vol. 108(5). P. 1067–1077.
Paul W.A. Janssen, Thomas O. Bergmeijer et al. Tailored P2Y12 inhibitor treatment in patients undergoing non-urgent PCI-the POPular Risk Score study // Eur J Clin Pharmacol. 2019. Vol. 75(9). P. 1201–1210.
Chi-Hsiao Yeh, Yi-Ju Chou et al. Artificial-Intelligence-Assisted Discovery of Genetic Factors for Precision Medicine of Antiplatelet Therapy in Diabetic Peripheral Artery Disease // Biomedicines. 2022. Vol. 10(1). P.116.
3
Персонализированная медицина в сердечно-сосудистой хирургии
Прогнозирование риска жизнеугрожающих осложнений после кардиохирургических операции являются краеугольным камнем оценки качества оказываемой помощи. Актуальные клинические рекомендации рекомендуют дооперационную оценку риска с использованием валидированных шкал EuroSCORE-II и STS. Однако все больше авторов заявляет о недостаточной точности этих шкал при использовании на практике.
Набирающие популярность в медицине методы машинного обучения имеют превосходство над традиционными методами статистического анализа и являются многообещающими инструментами для персонального прогнозирования неблагоприятных послеоперационных исходов в кардиохирургии. Результаты, полученные в ряде исследований, свидетельствуют о преимуществах использования методов машинного обучения в прогнозной персонализированной аналитике при оказании кардиохирургической помощи, что обусловлено более высокой дискриминацией моделей машинного обучения в сравнении с традиционно используемой логистической регрессией, на основе которой были разработаны применяющиеся в настоящий момент шкалы риска.
Набирающие популярность в медицине методы машинного обучения имеют превосходство над традиционными методами статистического анализа и являются многообещающими инструментами для персонального прогнозирования неблагоприятных послеоперационных исходов в кардиохирургии. Результаты, полученные в ряде исследований, свидетельствуют о преимуществах использования методов машинного обучения в прогнозной персонализированной аналитике при оказании кардиохирургической помощи, что обусловлено более высокой дискриминацией моделей машинного обучения в сравнении с традиционно используемой логистической регрессией, на основе которой были разработаны применяющиеся в настоящий момент шкалы риска.
Технология 3D-печати все больше признается в качестве ценного инструмента хирургического планирования, позволяющего получить представление о сложных внутрисердечных структурах с точными размерами и предоставляющего хирургу возможность визуализировать сердце перед операцией.
Протезирование аортального клапана неостворками из аутоперикарда
операции Оzaki, при доступности данных визуализации (компьютерная томография или магнитно-резонансная томография сердечных структур), модели корня аорты для конкретного пациента могут быть напечатаны в короткие сроки, что позволяет хирургу определить персональный размер створок аортального клапана и подготовить их до начала операции.
Протезирование аортального клапана неостворками из аутоперикарда
операции Оzaki, при доступности данных визуализации (компьютерная томография или магнитно-резонансная томография сердечных структур), модели корня аорты для конкретного пациента могут быть напечатаны в короткие сроки, что позволяет хирургу определить персональный размер створок аортального клапана и подготовить их до начала операции.
Расслоение аорты типа I часто сопровождаются диссекцией брахиоцефальных артерий, формируя очаги мальперфузии в двух и более артериальных бассейнах.
Применение стандартной методики протезирования дуги аорты не может учесть всех вариантов особенностей кровотока в поврежденной аорте и жизненно-важных сосудах. В данном случае только применение персонализированных подходов позволяет безопасно выполнить вмешательство. Персонализированных подход включает в себя выбор индивидуального типа перфузии, зон артериальной канюляции, сопоставимых между собой типов протезов дуги аорты и брахиоцефальной зоны.
Эти протезы различаются по количеству бранш, их диаметру, трехмерному расположению бранш. Планирование и изготовление таких групп протезов производится под конкретную клиническую ситуацию на основе трехмерных моделей, полученных при КТ, а также с учетом функциональных проб, определяющих клиническую значимость пораженных артерий.
Для повышения эффективности следует использовать две группы протезов: протезы зоны брахиоцефального сегмента и зоны дуги аорты. Каждая из этих групп позволяет персонифицировано решить уникальную клиническую задачу по протезированию в соответствующей зоне, но при этом сохраняется полная унификация соединения обеих групп протезов на завершающем этапе вмешательства.
Выбор оптимального способа протезирования и изготовление протезов сложной формы, соответствующих варианту расслоения, позволяет сократить время операции, увеличить ее радикальность, выполнить вмешательство на брахиоцефальных артериях без прекращения церебрального и системного кровотока.
Применение стандартной методики протезирования дуги аорты не может учесть всех вариантов особенностей кровотока в поврежденной аорте и жизненно-важных сосудах. В данном случае только применение персонализированных подходов позволяет безопасно выполнить вмешательство. Персонализированных подход включает в себя выбор индивидуального типа перфузии, зон артериальной канюляции, сопоставимых между собой типов протезов дуги аорты и брахиоцефальной зоны.
Эти протезы различаются по количеству бранш, их диаметру, трехмерному расположению бранш. Планирование и изготовление таких групп протезов производится под конкретную клиническую ситуацию на основе трехмерных моделей, полученных при КТ, а также с учетом функциональных проб, определяющих клиническую значимость пораженных артерий.
Для повышения эффективности следует использовать две группы протезов: протезы зоны брахиоцефального сегмента и зоны дуги аорты. Каждая из этих групп позволяет персонифицировано решить уникальную клиническую задачу по протезированию в соответствующей зоне, но при этом сохраняется полная унификация соединения обеих групп протезов на завершающем этапе вмешательства.
Выбор оптимального способа протезирования и изготовление протезов сложной формы, соответствующих варианту расслоения, позволяет сократить время операции, увеличить ее радикальность, выполнить вмешательство на брахиоцефальных артериях без прекращения церебрального и системного кровотока.
Улучшение жизненного прогноза после операции на открытом сердце, кроме успешно выполненного кардиохирургического вмешательства, в высокой̆ степени зависит от соблюдения пациентом рекомендаций врача, касающихся медикаментозной терапии и физической активности, и регулярного контроля параметров сердечно-сосудистой̆ системы: уровня артериального давления (АД), контроля электрокардиограммы (ЭКГ) и т.д.
На сегодняшний̆ день потенциально эффективным инструментом являются программы дистанционного мониторинга пациентов с использованием персональных гаджетов, которые отчасти уже разработаны и могут быть внедрены в реальную клиническую практику. Использование таких программ позволяет выявлять нарушения ритма сердца, контролировать уровень артериального давления, уровень физической̆ активности и прием медикаментозной терапии пациентами после проведенной кардиохирургической операции.
На сегодняшний̆ день потенциально эффективным инструментом являются программы дистанционного мониторинга пациентов с использованием персональных гаджетов, которые отчасти уже разработаны и могут быть внедрены в реальную клиническую практику. Использование таких программ позволяет выявлять нарушения ритма сердца, контролировать уровень артериального давления, уровень физической̆ активности и прием медикаментозной терапии пациентами после проведенной кардиохирургической операции.

Использование непрерывного дистанционного мониторинга пациентов с имплантированными электрокардиостимуляторами способно обеспечить новый уровень детализации диагностических данных, позволяя расширить тактику ведения пациентов от имплантации устройства до лечения заболеваний. Удаленное наблюдение за пациентами с имплантируемыми электрокардиостимуляторами включает в себя дистанционный мониторинг, при котором выполняется контроль устройства, которое автоматически передает тревожные события, в том числе инициированные пациентом из-за опасений о возможной неисправности устройства или подозрения на аритмию или другое клиническое событие. Система удаленного мониторинга обеспечивает непрерывную диагностику и позволяет сократить количество предписанных врачом посещений клиники пациентам.
Рекомендации ESC/EACTS по реваскуляризации миокарда 2018 // Российский кардиологический журнал. 2019;(8):151–226. DOI: 10.15829/1560-4071-2019-8-151-226
Allyn J., Allou N., Augustin P. et al. Comparison of a Machine Learning Model with EuroSCORE II in Predicting Mortality after Elective Cardiac Surgery: A Decision Curve Analysis // PLoS One. 2017;6;12(1):e0169772. DOI: 10.1371/journal.pone.0169772
72. Molina R.S., Molina-Rodríguez M.A., Rincón F.M., Maldonado J.D. Cardiac Operative Risk in Latin America: A Comparison of Machine Learning Models vs EuroSCORE-II // Ann Thorac Surg. 2022;113(1):92-99. DOI: 10.1016/j.athoracsur.2021.02.052
72. Molina R.S., Molina-Rodríguez M.A., Rincón F.M., Maldonado J.D. Cardiac Operative Risk in Latin America: A Comparison of Machine Learning Models vs EuroSCORE-II // Ann Thorac Surg. 2022;113(1):92-99. DOI: 10.1016/j.athoracsur.2021.02.052
Benedetto U., Dimagli A., Sinha S. et al. Machine learning improves mortality risk prediction after cardiac surgery: Systematic review and meta-analysis // J Thorac Cardiovasc Surg. 2022. 163(6):2075-2087.e9. DOI: 10.1016/j.jtcvs.2020.07.105
Ozaki S., Kawase I., Yamashita H. et al. Aortic Valve Reconstruction Using Autologous Pericardium for Aortic Stenosis // Circ J. 2015;79(7):1504-10. DOI: 10.1253/circj.CJ-14-1092. PMID: 25818901
Pirola S., Mastroiacovo G., Mostardini G. et al. Preoperative Ozaki technique measures on tridimensional engineered root // J Cardiovasc Comput Tomogr. 2022;16(1):51-53. DOI: 10.1016/j.jcct.2021.09.008
Vegesna A., Tran M., Angelaccio M., Arcona S. Remote patient monitoring via non-invasive digital technologies: a systematic review // Telemed. J. E. Health. 2017; 23 (1): 3–17. DOI: 10.1089/ tmj.2016.0051
Varma N., Braunschweig F., Burri H. et al. Remote monitoring of cardiac implantable electronic devices and disease management // Europace. 2023. 2;25(9):euad233. DOI: 10.1093/europace/euad233
Зарегистрированные в мире лекарственные препараты или изделия, которые внедрены в практику и имеют персонализированные показания к применению
Понимание молекулярных механизмов патогенеза БСК и знания о генетической природе заболевания позволяют внедрять и новые терапевтические подходы, а также создавать новые классы препаратов.
Модуляторы функции саркомера.
Самым ярким примером может служить создание нового класса препаратов – модуляторов функции саркомера (АТФ-азной активности миозина) на основе малых молекул.
Ингибирование миозина оказалось эффективным лечебным воздействием, уменьшающим степень гипертрофии и обструкции выносящего тракта левого желудочка сердца (PMID 76878205).
Ингибирование миозина оказалось эффективным лечебным воздействием, уменьшающим степень гипертрофии и обструкции выносящего тракта левого желудочка сердца (PMID 76878205).
- В частности, появление нового препарата мавакамтена, а вслед за ним и омикамтива, является первым примером создания препарата для терапии КМП на основе знания о молекулярном патогенезе заболевания (PMID 34004177).
Препараты для лечения транстиретинового амилоидоза.
Другим примером создания препаратов на основе знания о молекулярном патогенезе заболевания являются препараты для лечения транстиретинового амилоидоза.
В настоящий момент доступно три класса различных по механизму препаратов:
В настоящий момент доступно три класса различных по механизму препаратов:
- на основе антител, стабилизрующих транстиретиновые тетрамеры;
- на основе микроРНК, снижающее синтез самого транстиретина;
- на основе антител, приводящих к разрушению и выведению нерастворимых амилоидных агрегатов.
Препараты для лечения кардиомиопатий, ассоциированных с системными и метаболическими заболеваниями.
В дополнение ряд новых препаратов активно разрабатывается в области детской кардиологии, в частности, при КМП, ассоциированных с системными и метаболическими заболеваниями.
Среди первых можно привести пример фермент-заместительной терапии у пациентов с болезнью Фабри. Также среди новых препаратов, направленных на молекулярный патогенез болезни Фабри, можно выделить шапероновую терапию, приводящую к стабилизации фермента альфа-галактозидазы, а также субстрат-редуцирующую терапию, снижающую потребность в эффективно-функционирующем нативном ферменте.
Еще одним примером может являться ферментзаместительная терапия α-глюкозидазой при болезни Помпе (PMID 31298581). Потенциальная возможность и клиническая перспективность разработки таких подходов подчеркивает важность своевременной диагностики пациентов с болезнями накопления и с КМП в рамках этих заболеваний.
Среди первых можно привести пример фермент-заместительной терапии у пациентов с болезнью Фабри. Также среди новых препаратов, направленных на молекулярный патогенез болезни Фабри, можно выделить шапероновую терапию, приводящую к стабилизации фермента альфа-галактозидазы, а также субстрат-редуцирующую терапию, снижающую потребность в эффективно-функционирующем нативном ферменте.
Еще одним примером может являться ферментзаместительная терапия α-глюкозидазой при болезни Помпе (PMID 31298581). Потенциальная возможность и клиническая перспективность разработки таких подходов подчеркивает важность своевременной диагностики пациентов с болезнями накопления и с КМП в рамках этих заболеваний.
Персонифицированные подходы применения препаратов у пациентов с РАСопатиями.
Персонифицированные подходы применения препаратов с учетом молекулярного патогенеза КМП развиваются и для еще одной тяжелой группы педиатрических пациентов – пациентов с РАСопатиями.
Поскольку в основе тяжелой гипертрофии миокарда в данном случае лежит активация проростовых и прогипертрофических сигнальных каскадов, применение различных киназных ингибиторов (МАP-киназ и тирозинкиназ) является потенциально эффективным при данной патологии. Поскольку такие препараты активно применяются в онкологии и разрешены к клиническому применению во всех возрастных группах, то попытки их использования с недавнего времени предпринимаются и в отношении пациентов с РАСопатиями.
Как единичные сообщения в формате описания клинических случаев, так и идущие клинические исследования показывают потенциальную эффективность ингибитора МЕК-киназ траметиниба. Описаны положительные эффекты данного препарата в виде уменьшения гипертрофии и обструкции левого желудочка, а также нормализация уровня NT-proBNP у пациентов первых месяцев жизни с ГКМП, вызванного мутацией RIT1 (PMID 31047013).
Несмотря на то, что эффективность и безопасность данных препаратов в отношении гипертрофии миокарда все еще остается спорной и требуют проведения более широких клинических исследований, потенциал их создания и использования в группе РАС-каскад-ассоциированной ГКМП очевиден. Среди других направлений применения уже созданных лекарств с известным действием по новым показаниям исследуется возможность применения препаратов sotatersept, tacralimus, ematinib, tamoxifen, модулирующих описанные новые молекулярные пути патогенеза, при легочной артериальной гипертензии
Поскольку в основе тяжелой гипертрофии миокарда в данном случае лежит активация проростовых и прогипертрофических сигнальных каскадов, применение различных киназных ингибиторов (МАP-киназ и тирозинкиназ) является потенциально эффективным при данной патологии. Поскольку такие препараты активно применяются в онкологии и разрешены к клиническому применению во всех возрастных группах, то попытки их использования с недавнего времени предпринимаются и в отношении пациентов с РАСопатиями.
Как единичные сообщения в формате описания клинических случаев, так и идущие клинические исследования показывают потенциальную эффективность ингибитора МЕК-киназ траметиниба. Описаны положительные эффекты данного препарата в виде уменьшения гипертрофии и обструкции левого желудочка, а также нормализация уровня NT-proBNP у пациентов первых месяцев жизни с ГКМП, вызванного мутацией RIT1 (PMID 31047013).
Несмотря на то, что эффективность и безопасность данных препаратов в отношении гипертрофии миокарда все еще остается спорной и требуют проведения более широких клинических исследований, потенциал их создания и использования в группе РАС-каскад-ассоциированной ГКМП очевиден. Среди других направлений применения уже созданных лекарств с известным действием по новым показаниям исследуется возможность применения препаратов sotatersept, tacralimus, ematinib, tamoxifen, модулирующих описанные новые молекулярные пути патогенеза, при легочной артериальной гипертензии
Молекулярно-обоснованная терапия у ламинопатий.
Еще одной группой КМП, для которой в настоящее время реализуется попытка применения молекулярно-обоснованной терапии, являются ламинопатии.
Так, после ряда экспериментальных исследований с использованием клеточных моделей и генетически-модифицированных животных была продемонстрирована потенциальная эффективность ингибиторов МАРК-киназного каскада в случае ламин-ассоциированных вариантов ДКМП, и в настоящее время завершено клиническое исследование третьей фазы препарата с применением таргетного препарата (PMID 29237693).
Речь идет об исследовании REALM-DCM (исследование ARRY-371797 (PF-07265803)) у взрослых пациентов с симптомной ДКМП, вызванной мутацией гена ламина A/C, в котором оценивалась эффективность ARRY-371797, перорального ингибитора митоген-активируемой протеинкиназы p38. Несмотря на первоначальное внимание ко взрослым, это исследование может улучшить понимание связанных генетических вариантов у детей, улучшить персонализированную стратификацию риска и обеспечить основу для разработки целевых методов лечения.
Так, после ряда экспериментальных исследований с использованием клеточных моделей и генетически-модифицированных животных была продемонстрирована потенциальная эффективность ингибиторов МАРК-киназного каскада в случае ламин-ассоциированных вариантов ДКМП, и в настоящее время завершено клиническое исследование третьей фазы препарата с применением таргетного препарата (PMID 29237693).
Речь идет об исследовании REALM-DCM (исследование ARRY-371797 (PF-07265803)) у взрослых пациентов с симптомной ДКМП, вызванной мутацией гена ламина A/C, в котором оценивалась эффективность ARRY-371797, перорального ингибитора митоген-активируемой протеинкиназы p38. Несмотря на первоначальное внимание ко взрослым, это исследование может улучшить понимание связанных генетических вариантов у детей, улучшить персонализированную стратификацию риска и обеспечить основу для разработки целевых методов лечения.
Использование вирусных носителей на основе адено-ассоциированных вирусов (AAV).
Безопасность и эффективность использования вирусных носителей на основе адено-ассоциированных вирусов (AAV) открыла новую эру в терапии генетически-обусловленных заболеваний. Это в полной мере коснулось и группы кардиомиопатий, а также генетически-обусловленных нарушений ритма. Поскольку в результате применения AAV-ассоциированной генной терапии восполняется функциональный эффект отсутствующего или дефектнофункционирующего гена, то разработка таких препаратов возможна только для кардиомиопатий, возникающих вследствие мутаций с потерей функции гена (loss of function).
Среди описанных генетических вариантов кардиомиопатий к ним, прежде всего, относятся КМП в рамках болезни Данона, а также ДКМП, ассоциированная с потерей функции белка RBM20, нарушения ритма вследствие дефектов кальциевого гомеостаза, а также для ряда митохондриальных кардиомиопатий.
Если для большинства перечисленных нозологий разработки генотерапевтических препаратов находятся на доклинической стадии, то в случае болезни Данона и ассоциированной с ней КМП промежуточные результаты активно идущего клинического исследования свидетельствуют об эффективности заместительной генной терапии в отношении LAMP2-ассоциированной гипертрофии миокарда.
Среди описанных генетических вариантов кардиомиопатий к ним, прежде всего, относятся КМП в рамках болезни Данона, а также ДКМП, ассоциированная с потерей функции белка RBM20, нарушения ритма вследствие дефектов кальциевого гомеостаза, а также для ряда митохондриальных кардиомиопатий.
Если для большинства перечисленных нозологий разработки генотерапевтических препаратов находятся на доклинической стадии, то в случае болезни Данона и ассоциированной с ней КМП промежуточные результаты активно идущего клинического исследования свидетельствуют об эффективности заместительной генной терапии в отношении LAMP2-ассоциированной гипертрофии миокарда.
Генная терапия в области кардиомиопатий и нарушений ритма.
Говоря о генной терапии в области КМП и нарушениях ритма, нельзя не упомянуть о первом заболевании с вовлечением сердечно-сосудистой системы, которое явилось объектом применения геномодифицирующей терапии. Речь идет о миодистрофии Дюшена/Бекера, частью фенотипа которых является ДКМП. Текущие руководства по лечению дистрофинопатий рекомендуют начинать терапию ингибиторами АПФ до подросткового возраста, когда пациенты находятся в стадии А (в группе риска) (PMID 30275251).
В настоящий момент ведутся попытки разработки генотип-специфичных алгоритмов расчета риска злокачественных желудочковых нарушений ритма сердца (ЖНР) и, соответственно, определения показаний к имплантации кардиовертера-дефибриллятора (ИКД), особенно для пациентов с ДКМП и аритмогенной кардиомиопатией (АКМП) на фоне частой мутации R14del в гене PLN (PMID 35699837, 34113975). Таким образом, в когорте пациентов с КМП четко прослеживается тенденция на создание ген-специфичных и даже мутаций-специфичных алгоритмов расчета риска злокачественных ЖНР и определения показаний к имплантации ИКД, что лишний раз подчеркивает важность формирования многоцентровых когорт пациентов с детальной информацией о генотип-фенотипических корреляциях.
- Первые исследования D. Duboc и соавторов показали, что ингибиторы АПФ замедляют развитие ДКМП и в итоге улучшают выживаемость (PMID 15766818, 17719312).
- Также для данных заболеваний общепризнанным эффективным генотерапевтическим подходом является exon-skipping терапия (терапия, приводящая к выключению патологических экзонов из рамки считывания – стратегия пропуска экзона). Подсчитано, что ≈70 % пациентов с делециями, ассоциированными с МДД, можно лечить с помощью стратегии пропуска экзона.
- В настоящее время US Food and Drug Administration (FDA) одобрены четыре антисмысловых олигонуклеотида (AONs), которые вводятся пациентам в виде еженедельных внутривенных инфузий, и «работают» пропуская поврежденные экзоны. Однако эта терапия ограничена определенными мутациями, сложностями проникновения AONs в ткань миокарда и скелетную мускулатуру, а также недостаточной эффективности, так как эта терапия обеспечивает лишь 5 % нормального содержания дистрофина (PMID 34898968).
- В частности, в доклинических исследованиях была показана возможность применения нуклеаз CRISPR/Cas9, способных к редактированию генома, с доставкой через аденоассоциированные вирусные векторы. Эти исследования направлены на восстановление рамки считывания гена для получения укороченного, но частично активного белка – подход, аналогичный лечению AONs. Как и в генной терапии, редактирование генов может потребовать только однократного введения. Учитывая тропность некоторых серотипов AAV к сердцу, данный подход обладает большим потенциалом в отношении ДКМП на фоне МДД (PMID 37288568).
В настоящий момент ведутся попытки разработки генотип-специфичных алгоритмов расчета риска злокачественных желудочковых нарушений ритма сердца (ЖНР) и, соответственно, определения показаний к имплантации кардиовертера-дефибриллятора (ИКД), особенно для пациентов с ДКМП и аритмогенной кардиомиопатией (АКМП) на фоне частой мутации R14del в гене PLN (PMID 35699837, 34113975). Таким образом, в когорте пациентов с КМП четко прослеживается тенденция на создание ген-специфичных и даже мутаций-специфичных алгоритмов расчета риска злокачественных ЖНР и определения показаний к имплантации ИКД, что лишний раз подчеркивает важность формирования многоцентровых когорт пациентов с детальной информацией о генотип-фенотипических корреляциях.
Персонифицированный подход в отношении генетически-обусловленных заболеваний, в частности, при кардиомиопатиях и наследственных нарушениях ритма, основан, прежде всего, на корректной постановке генетического диагноза и определении генетического дефекта, лежащего в основе заболевания, но не ограничивается этим. Современные знания о генетике кардиомиопатий позволяют разрабатывать геноспецифичные алгоритмы расчета рисков, определять показания к высокотехнологичным методам лечения и выстраивать прогноз заболевания исходя из генетического фона. Знание генетической природы и молекулярных механизмов развития заболеваний позволило разработать ряд новых геноспецифичных пепаратов для персонифицированной терапии, и их количество в ближайшее время будет постоянно увеличиваться. Комплексное ведение пациентов с КМП с учетом возрастной группы, генетического дефекта и наличия новых терапевтических подходов определяет возможности прецизионной медицины в данной группе пациентов.
https://clinicaltrials.gov
Анализ полноты исследований экспертной группой
Анализируя основные достижения российской науки и индустрии в направлении ПМ при болезнях системы кровообращения, необходимо отметить широкую географию научных исследований: научные организации практически из всех регионов РФ вовлечены в решение вопросов ПМ.
Основные направления научных исследований по ПМ при болезнях системы кровообращения в РФ направлены преимущественно на усовершенствование способов оценки индивидуального риска развития и прогрессирования заболеваний сердечно-сосудистой системы на основе идентификации причинных молекулярно-генетических маркеров и других биомаркеров, а также на изучение возможностей использования биомаркеров и генетических маркеров для мониторинга эффективности лечения и оценки прогноза пациента.
Проведение исследований по данным направлениям позволило существенно повысить диагностическую и прогностическую точность рутинных методов обследования пациентов при различных патологиях сердечно-сосудистой системы, включая такие социально значимые заболевания, как ишемическая болезнь сердца, артериальная гипертензия и хроническая сердечная недостаточность.
Однако существенным барьером на пути внедрения алгоритмов и способов персонифицированного прогнозирования клинического течения и исходов заболевания является высокая стоимость используемых лабораторных методов исследования, необходимость специальных условий и высококвалифицированных специалистов для проведения генетических исследований, что, с учетом труднодоступности отдельных удаленных районов РФ, приводит к недоступности данных методов для большинства лечебных учреждений практического здравоохранения.
Основные направления научных исследований по ПМ при болезнях системы кровообращения в РФ направлены преимущественно на усовершенствование способов оценки индивидуального риска развития и прогрессирования заболеваний сердечно-сосудистой системы на основе идентификации причинных молекулярно-генетических маркеров и других биомаркеров, а также на изучение возможностей использования биомаркеров и генетических маркеров для мониторинга эффективности лечения и оценки прогноза пациента.
Проведение исследований по данным направлениям позволило существенно повысить диагностическую и прогностическую точность рутинных методов обследования пациентов при различных патологиях сердечно-сосудистой системы, включая такие социально значимые заболевания, как ишемическая болезнь сердца, артериальная гипертензия и хроническая сердечная недостаточность.
Однако существенным барьером на пути внедрения алгоритмов и способов персонифицированного прогнозирования клинического течения и исходов заболевания является высокая стоимость используемых лабораторных методов исследования, необходимость специальных условий и высококвалифицированных специалистов для проведения генетических исследований, что, с учетом труднодоступности отдельных удаленных районов РФ, приводит к недоступности данных методов для большинства лечебных учреждений практического здравоохранения.
- С точки зрения практического внедрения, методы персонифицированной медицины наиболее актуальны для больных с доказанным высоким вкладом генетического компонента в развитие и прогрессирование заболевания. В первую очередь, это имеет отношение к наследственным кардиомиопатиям, точная генетическая диагностика которых во многом определяет тактику дальнейшего лечения и прогноз пациента, а также своевременный скрининг родственников пациента при наличии показаний, что может обеспечить у таких лиц предотвращение развития заболевания или его более позднюю манифестацию.
- Что касается заболеваний с полигенным типом наследования, таких как артериальная гипертензия и ишемическая болезнь сердца, на сегодняшний день определены сотни локусов и генов, ассоциированных с развитием и прогрессированием данных заболеваний. В научной литературе, опубликованной российскими учеными за анализируемый промежуток времени, большое внимание уделено вопросам персонифицированного прогнозирования исходов данных заболеваний в зависимости от наличия тех или иных однонуклеотидных полиморфизмов генов. Вместе с тем наиболее перспективным в данной области является проведение исследований с использованием технологий полногеномного секвенирования. Это особенно актуально для такой многонациональной страны, как РФ, поскольку этнические генетические особенности имеют место в том числе и при патологиях сердечно-сосудистой системы с полигенным типом наследования.
- Число научных исследований с применением технологий полногеномного секвенирования при БСК в РФ продолжает увеличиваться. Однако в литературе активно обсуждается несколько вопросов, связанных с данными исследованиями: экономическая эффективность данных методов исследования; проблема хранения, доступа и защиты данных полногеномного секвенирования. Ассоциации генов с теми или иными патологическими состояниями, продемонстрированные по данным полногеномного секвенирования, в дальнейшем должны верифицироваться на основании генетического анализа однонуклеотидных полиморфизмов для подтверждения наличия связи с развитием и прогрессированием заболевания, в том числе с учетом этнической принадлежности индивида.
- Исходя из приведенных данных, видна ключевая роль больших наборов данных и коллекций образцов ДНК пациентов с заболеваниями сердечно-сосудистой системы для проведения эффективных научных исследований. Решить эту проблему, вероятно, может внедрение информационных медицинских систем с возможностью их интеграции и сложной компьютерной обработки. А также создание крупных регистров по отдельным нозологиям, в том числе редким заболеваниям сердечно-сосудистой системы.
- Анализ больших объемов данных невозможен без применения технологий искусственного интеллекта. Научные исследования в области применения технологий машинного обучения и искусственного интеллекта в отечественной медицинской науке также набирают все большую популярность и позволяют получать уникальные научные данные, обладающие высокими перспективами внедрения в практическое здравоохранение, в том числе разрабатываются алгоритмы персонального расчета параметров имплантируемых клапанов сердца, стентов, применения отдельных групп лекарственных препаратов
- Проведение научных исследований по поиску молекулярно-генетических предикторов развития и прогрессирования заболеваний сердечно-сосудистой системы активно поддерживается Министерством здравоохранения РФ, Министерством науки и высшего образования РФ и Российским научным фондом
- Другой пул исследований, отвечающих критериям персонализированной медицины, относится к исследованию фундаментальных процессов жизнедеятельности клеток и тканей в норме и при патологии. Исследования отечественных ученых в данной области полностью соответствуют мировому уровню.
- Большое внимание уделяется вкладу субклеточных структур (микровезикул) в процессы воспаления, фиброгенеза, атерогенеза при сердечно-сосудистых заболеваниях. Пристальное внимание ученых обращено на такие органеллы клетки, как митохондрии. Исследование структуры и функции митохондрий в норме и при патологии, в том числе ишемическом повреждении, обеспечивает высокие перспективы обнаружения новых терапевтических мишеней, которые будут способствовать повышению эффективности медикаментозных методов лечения сердечно-сосудистых заболеваний. Исследуется роль микроРНК, которые представляют собой короткие некодирующие РНК длиной 18–25 нуклеотидов, регулирующие около трети генома на посттранскрипционном уровне. Российскими учеными показано значение микроРНК в качестве маркеров прогноза при ишемической болезни сердца, включая острый инфаркт миокарда, отторжении трансплантированного сердца, тромбозах глубоких вен, цереброваскулярных заболеваниях и т.д. Таким образом, данное направление научных работ является крайне перспективным с точки зрения позиционирования российской науки на мировом уровне и подготовки научного «фундамента» для проведения дальнейших, более практически ориентированных исследований с перспективой внедрения в рутинную клиническую практику.
Несмотря на успехи российской науки в области персонифицированной медицины по направлениям диагностики и прогнозирования болезней системы кровообращения, в вопросах применения персонализированных методов в лечении заболеваний и коррекции состояний, в том числе персонализированное применение лекарственных препаратов, основанное на анализе генетических особенностей и биомаркеров, существуют определенные трудности. На фоне общемирового роста числа препаратов с доказанным действием на геном и молекулярные механизмы реализации генетических заболеваний в РФ отечественных препаратов с таким профилем активности не зарегистрировано. Это может быть обусловлено колоссальным размером затрат, необходимых для разработки таргетных молекул, которые не могут быть компенсированы средствами государственного задания или грантом научного фонда. В данной области необходимо внедрение более масштабных мер государственной поддержки с привлечением крупных инвестиций. Развитие данного направления в медицинской науке является крайне важным в первую очередь в долгосрочной перспективе, в том числе с точки зрения импортозамещения/импортоопережения и обеспечения лекарственной безопасности населения РФ.
Сильные и слабые стороны. Предложения по перспективному планированию

Сильными сторонами направления персонализированной медицины при болезнях системы кровообращения в РФ является широкий спектр научных исследований, проводимых на высоком мировом уровне, посвященных вопросам диагностики и персонификации прогноза пациентов при различных заболеваниях сердечно-сосудистой системы. Данное направление исследований активно поддерживается научным фондом и профильными Министерствами РФ.
Вопросы разработки и применения медикаментозных препаратов с таргетной направленностью менее изучены в российской популяции. В данной области необходимо принятие управленческих решений, направленных на привлечение крупных инвестиций для разработки новых терапевтических молекул, способных модицифировать влияние патологических мутаций генов.

Ближайшими перспективами развития ПМ по направлению БСК является разработка стратегий внедрения омиксных технологий в реальную клиническую практику. Трансляция результатов научных исследований с высокой доказательной базой в клинические рекомендации по нозологиям сердечно-сосудистой системы с выделением отдельного финансирования и проработкой маршрутизации образцов биоматериала пациента в профильные научно-диагностические центры (при отсутствии возможности проведения генетической диагностики по месту жительства).
Необходимо расширение спектра специальных образовательных программ по направлению ПМ при БСК с размещением информации в сети интернет и возможностью дополнительной профессиональной подготовки на базе программы непрерывного медицинского образования. Также существует необходимость более углубленного изучения основ генетики и информационных технологий в медицинских высших учебных заведениях для подготовки специалистов, способных глубоко понимать и развивать направление персонализированной медицины, которое в обозримом будущем будет укреплять свои позиции в сфере оказания качественной медицинской помощи населению РФ.
Эндокринология
Основные направления мировых исследований
Современные представления о ПМ в эндокринологии являются классическими терапевтическими подходами, базирующимися на «трех китах» – профилактике, диагностике и лечении, но примененными с обязательным учетом индивидуальных особенностей организма (генетических, физиологических, биохимических и др.) и течения заболевания.
Значительные усилия направлены на разработку методов выявления болезни на ранних стадиях ее развития. Для прогнозирования риска необходимо выявление факторов, влияющих на риск развития заболевания. Ни один отдельно взятый фактор не способен точно спрогнозировать риск развития и характер течения заболевания, но несколько факторов, объединенные в шкалу риска, дают достаточно точный прогноз.
Основные направления исследований:
Значительные усилия направлены на разработку методов выявления болезни на ранних стадиях ее развития. Для прогнозирования риска необходимо выявление факторов, влияющих на риск развития заболевания. Ни один отдельно взятый фактор не способен точно спрогнозировать риск развития и характер течения заболевания, но несколько факторов, объединенные в шкалу риска, дают достаточно точный прогноз.
Основные направления исследований:
- Разработка полигенных и комбинированных шкал риска развития ожирения, сахарного диабета, других эндокринных заболеваний. Оценка полигенного риска позволяет не только улучшить прогноз развития заболевания, но и риск развития его осложнений.
- На основе омиксных технологий идентификация метаболитов, играющих ключевые роли в прогнозе событий (например, развитие тех или иных осложнений СД).
- Идентифицикация причинных вариантов развития моногенных форм сахарного диабета («диабет молодых со взрослым началом» – maturity-onset diabetes of the young (MODY)), характеризующийся моногенными дефектами функции β-клеток с использованием технологии экзомного секвенирования.
- Прогнозирование эффективности лечения СД2 той или иной группой препаратов на основе ПШР и комбинированных шкал.
- Разработка новых терапевтических стратегий на основе системных исследований, использующих методологию реконструкции сетей молекулярных взаимодействий.
- Разработка и использование на основе компьютерных технологий медицинских помощников, систем поддержки принятия решения в прогнозировании, диагностике и лечении ожирения, СД и других эндокринных заболеваний.
- Совершенствование систем мониторинга и контроля уровня глюкозы, например, в формате «искусственной поджелудочной железы» (закрытая петля).
- Использование клеточных технологий, основанных на замещении β-клеток для лечения больных диабетом, индукция пролиферации стволовых клеток по пути инсулин-продуцирующих клеток.
- Геномные технологии для разработки новых таргетных препаратов.
- Изучение микробиома и его изменений при различных эндокринных заболеваниях для создания пробиотиков, восстанавливающих нормальный бактериальный состав.
- Разработка систем таргетной доставки препаратов в различные органы и ткани. В частности, систем доставки препаратов в жировую ткань для активации в ней обменных процессов, браунинга и расхода энергии.
- Разработка новых способов доставки инсулина в организм: подкожные патчи; разворачивающиеся при пероральном приеме устройства с микроиглами; проглатываемые микроаппликаторы, которые прилипают к тканям желудочно-кишечного тракта и доставляют откалиброванные дозы инсулина (доклинические исследования); пероральные и ингаляционные формы инсулина.
- Предотвращение развития СД1 путем формирования иммунологической интолерантности (моноклональные антитела).
- Идентификация новых молекулярно-генетических механизмов развития нейроэндокринных опухолей, в том числе поиск новых герминальных, спорадических и соматических мутаций, приводящих к развитию этих заболеваний.
- Внедрение мультиомиксных технологий, включающих изучение метилома, транскриптома, протеома, гликома нейроэндокринных опухолей для улучшения понимания механизмов их патогенеза, биологического поведения и прогноза.
- Использование новых мишеней таргетной терапии нейроэндокринных опухолей.
- Разработка способов прогнозирования ответа на различные виды лечения нейроэндокринных опухолей.
- Внедрение тераностики в алгоритмы ведения больных с нейроэндокринными опухолями.
Основные достижения ПМ и примеры успешной реализации в мире
1
Диабет и ожирение
GWAS показали вклад полигенных изменений в риск ожирения. К настоящему времени разработаны полигенные шкалы риска (ПШР) ожирения, которые позволяют определить людей, имеющих увеличенный риск его развития.
- Так, ПШР,разработанная в 2019 г. на основании анализа четырех когорт (UKBB, Partners Healthcare, Framingham Offspring/CARDIA и Avon Longitudinal Study of Parents and Children), показала, что 43 % участников, имевших самый высокий 10 % риск по ПШР, страдали ожирением (ИМТ≥30 кг/м2) по сравнению с 9,5 % среди тех, кто был в самом низком 10 % риске.
- GWAS выявили множество генетических локусов, связанных с СД2. По отдельности эти генетические варианты имеют очень небольшой эффект, но комбинация сотен наиболее значимых из них в ПШР может дать существенный вклад в прогнозирование риска полигенных заболеваний, таких как СД2.
- ПШР показали многообещающие результаты в предикции СД2. Однако большинство исследований показало, что комбинация клинических факторов риска (возраст, пол, ИМТ, СД у родителей, уровни давления, ХС-ЛПВП и триглицеридов) обеспечивала более точный прогноз для развития СД2, чем ПШР [C-статистическая-величина: 0,835 (0,831–0,839) по сравнению с 0,763 (0,758–0,767) соответственно].
- В то же время добавление ПШР к клиническим моделям риска способно в определенной мере улучшить прогноз.
Еще одним важным фактором, влияющим на точность генетического прогнозирования СД2 и других полигенных заболеваний, является расовая и национальная принадлежность. Из уже установленных фактов на это указывает более быстрая прогрессия СД у азиатов и более высокая чувствительность к инкретиномиметикам у людей страдающих СД2 и проживающих в Китае и Японии.
Геномные исследования служат толчком для создания новых лекарственных препаратов. Например, было показано, что полиморфизм в гене TCF7L2 опосредует терапевтический эффект аналогов глюкагоноподобного пептида-1. Гены PPARG и KCNJ11 функционально связаны с мишенями для сахароснижающих препаратов –тиазолидиндионов и производных сульфонилмочевины.
Использование технологии экзомного секвенирования позволило идентифицировать новые причинные мутации моногенных форм сахарного диабета, например, обнаружены дефекты в гене GATA6. Такие исследования позволяют понять механизм реализации патологического процесса, поэтому необходимы в клинической практике для постановки своевременного диагноза.
Использование технологии экзомного секвенирования позволило идентифицировать новые причинные мутации моногенных форм сахарного диабета, например, обнаружены дефекты в гене GATA6. Такие исследования позволяют понять механизм реализации патологического процесса, поэтому необходимы в клинической практике для постановки своевременного диагноза.
Разработка медицинских помощников и систем поддержки принятия решения наиболее активно развивается в прогнозировании, диагностике и лечении ожирения, СД и других эндокринных заболеваний. При СД искусственный интеллект в сочетании с медицинскими приборами, носимыми устройствами и смартфонами, может помочь врачам и пациентам, улучшая прогнозирование риска и диагностические модели, тем самым повышая персонализацию лечения и самоконтроль заболевания.
При гестационном диабете разработано несколько приложений mHealth для регистрации информации о пациентке и предоставления общих советов и рекомендаций. Однако, по данным иностранной литературы, практически нет инструментов, объединяющих mHealth и ИИ, которые были бы созданы для расширения возможностей женщин с гестационным диабетом и помощи в принятии клинических решений как медицинскими работниками, так и пациентами [13].
- В ходе шестинедельного исследования было показано, что усовершенствованный болюсный калькулятор на основе ИИ для лечения диабета 1-го типа эффективен в качестве вспомогательной системы для самостоятельного лечения этого заболевания, причем у пациентов, использующих это устройство, не наблюдалось эпизодов гипогликемии.
- В метанализе исследований влияния мобильных приложений на контроль гликемии у молодых пациентов с СД 1-го типа вспомогательные приложения с калькулятором углеводов и доз инсулина благоприятно влияли на снижение HbA1c.
При гестационном диабете разработано несколько приложений mHealth для регистрации информации о пациентке и предоставления общих советов и рекомендаций. Однако, по данным иностранной литературы, практически нет инструментов, объединяющих mHealth и ИИ, которые были бы созданы для расширения возможностей женщин с гестационным диабетом и помощи в принятии клинических решений как медицинскими работниками, так и пациентами [13].
В последние годы различные миРНК определены как возможные цели лечения, однако практическая разработка таких препаратов только начинается.
- В 2022 г. в России зарегистрирован инновационный инъекционный препарат для лечения дислипидемии – инклисиран (торговое наименование Симбрава). Это первый и единственный в классе гиполипидемических средств препарат, созданный на основе малой интерферирующей РНК.
- Препарат инклисиран показан для лечения пациентов с первичной гиперхолестеринемией (семейной гетерозиготной и несемейной гиперхолестеринемией) или смешанной дислипидемией в качестве дополнения к диете.
- Основанием для регистрации инклисирана стали результаты клинических испытаний III фазы ORION-9, -10 и -11. В клинических исследованиях приняли участие более 3,5 тыс. пациентов с сердечно-сосудистыми заболеваниями или гетерозиготной семейной гиперхолестеринемией, принимающих максимальные дозы статинов. Одна инъекция инклисирана в шесть месяцев достоверно снижала уровень ХЛНП на 52 % относительно исходного уровня к 17-му месяцу терапии и удерживал его снижение на 54 % на постоянном уровне в течение последующего периода лечения.
Первая коммерческая замкнутая система MiniMed 670G (Medtronic, Northridge, CA, USA) была одобрена Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США еще в сентябре 2016 г. для использования людьми с диабетом 1-го типа в возрасте от 14 лет и старше. Дальнейшее развитие технологий в этом направлении шла, с одной стороны, по пути микронизации, точности и скорости реагирования, с другой – по пути создания бигормональных систем, сочетающих глюкагон или амилин с инсулином.
В последние годы ведутся работы, предполагающие использование клеточных технологий, основанных на замещении β-клеток для лечения больных диабетом. Стволовые клетки могут быть потенциальным источником инсулин-продуцирующих клеток. Результаты показывают, что в качестве источника инсулин-продуцирующих клеток для аллогенной трансплантации могут выступать как эмбриональные, так и взрослые стволовые клетки. Основной проблемой остается обеспечение иммунологической интолерантности полученных β-клеток, что обеспечивается созданием «обезличенных» клеток и созданием микросфер с селективной проницаемостью.
В плане разработки новых методов доставки инсулина в организм клинические испытания ведутся для пероральных инсулинов.
Компания Орамед начала клиническое исследование (КИ) комбинированного перорального инсулина с ингибиторами ферментов ORMD-0801 в ноябре 2020 г., в настоящее время исследование завершилось.
Компания Орамед начала клиническое исследование (КИ) комбинированного перорального инсулина с ингибиторами ферментов ORMD-0801 в ноябре 2020 г., в настоящее время исследование завершилось.
- Первоначальный анализ показал, что исследование не достигло первичной конечной точки, однако в дальнейшем установлено, что субпопуляция пациентов с объединенными специфическими параметрами, такими как индекс массы тела (ИМТ), исходный уровень HbA1c, возраст, пол и масса тела, хорошо реагировала на пероральный инсулин.
- Эти подгруппы продемонстрировали статистически значимое снижение HbA1c с поправкой на плацебо более, чем на 1 %.
- Из сверхдлинных стоит отметить инсулин, который вводится один раз в неделю – Icodec. Комапания Новонордиск завершила КИ данного препарата и в августе 2023 г. заявила о намерении подать заявку на его регистрацию в США, ЕС и Китае.
Исследования, направленные на предотвращение развития СД1 путем формирования иммунологической интолерантности (моноклональные антитела), увенчались успехом в 2022 г.: 17 ноября 2022 г. впервые в истории диабетологии FDA (США) зарегистрировало препарат – теплизумаб – для замедления развития СД 1-го типа (СД1) у взрослых и детей в возрасте 8 лет и старше, у которых в настоящее время диагностирован СД1 на «доклинической» стадии, т.е. при наличии дисгликемии недиабетического уровня и нескольких специфических антител к β-клеткам поджелудочной железы.
Одобрение препарата получено по итогам исследования TriaL Net-10, в котором внутривенно вводили теплизумаб (антитело к СD3) в течение 14 дней и получили снижение на 40 % вероятности развития СД1 за период наблюдения.
Одобрение препарата получено по итогам исследования TriaL Net-10, в котором внутривенно вводили теплизумаб (антитело к СD3) в течение 14 дней и получили снижение на 40 % вероятности развития СД1 за период наблюдения.
- При долгосрочном наблюдении за участниками исследования было зафиксировано, что клинический дебют СД1 удавалось отсрочить на 2,5–3 года!
- Несмотря на относительную скромность исследования, нельзя не выделить принципиально новый долгожданный результат: появилось антитело, способное существенно замедлить развитие СД1 у лиц с высокой вероятностью его развития (родственники лиц с СД1, имеющие антитела к глутаматдекарбоксилазе и дисгликемию недиабетического уровня), но не для людей с уже состоявшимся дебютом СД1, что определяет «терапевтическое окно» времени вмешательства.
Арсенал средств для лечения СД 2-го типа (СД2) пополнился новым препаратом – двойным агонистом рецепторов глюкагоноподобного пептида 1-го типа и глюкозозависимого инсулинотропного полипептида.
Этот препарат – Тирзепатид (Mounjaro™) – был одобрен в мае 2022 г. FDA (США) для подкожных инъекций один раз в неделю для контроля гликемии.
Этот препарат – Тирзепатид (Mounjaro™) – был одобрен в мае 2022 г. FDA (США) для подкожных инъекций один раз в неделю для контроля гликемии.
- В программе исследований SURPASS (всего восемь исследований третьей фазы) было показано, что препарат не только эффективно снижает уровень гликированного гемоглобина (HbA1c), но и превосходит все препараты сравнения по степени снижения массы тела.
- В США препарат одобрен в трех дозах (5, 10 или 15 мг).
- Лечение препаратом приводит к снижению HbA1c на 1,8–2,0 пункта и массы тела на 7–10 кг (в зависимости от дозы) в течение 40 недель лечения. 2/3 участников исследования (более 60 %), принимавших самую высокую дозу, удалось снизить массу тела на 20 %.
Персонифицированная терапия пациентов с СД2 и хронической болезнью почек (ХБП) пополнилась нестероидным антагонистом минералокортикоидных рецепторов (МКР).
Первый представитель этого класса препаратов – финеренон, зарегистрирован в США и Европе в 2022 г.
Первый представитель этого класса препаратов – финеренон, зарегистрирован в США и Европе в 2022 г.
- В серии рандомизированных клинических исследований (FIDELIO-DKD и FIGARO-DKD, объединенных в программу FIDELITY) препарат доказал высокую эффективность не только как нефропротектор, но и в качестве кардиопротектора.
- Через три года терапии финереноном, в добавление к максимально переносимым дозам ингибиторов ренин-ангиотензиновой системы, у пациентов с СД2 и ХБП отмечалось значимое снижение рисков сердечно-сосудистых событий на 14 % (Р = 0,0018) и почечных событий на 23 % (P = 0,0002), независимо от исходных значений расчетной скорости клубочковой фильтрации, уровня альбуминурии, HbA1c.
- Механизм нефропротективного действия препарата связывают с противовоспалительным и антифибротическим действиями антагонистов МКР на уровне почечного интерстиция, что является уникальным и не присущим другим классам нефропротекторов (блокаторам ренин-ангиотензиновой системы и глифлозинам).
- Существенное преимущество этого класса препаратов, в отличие от стероидных антагонистов МКР, – значимо меньшее развитие побочных явлений, таких как гиперкалиемия и гирсутизм.
Установлено, что применение пиоглитазона в малых дозах позволяет снизить риск развития инсульта, инфаркта миокарда, а также развития СД2 у лиц без СД. При этом риск развития отечного синдрома, в том числе прогрессирования сердечной недостаточности, а также набора массы тела был ниже на фоне приема доз менее 45 мг/сут.
Дополнительно, несмотря на данные мета-анализов, свидетельствующих о нейтральных эффектах ингибиторов натрий-глюкозного котранспортера 2-го типа (иНГЛТ-2) в отношении фатальных, нефатальных инсультов, а также относительно влияния на частоту развития инсультов в целом, наблюдаются различия во влиянии препаратов на частоту различных подтипов инсультов.
Дополнительно, несмотря на данные мета-анализов, свидетельствующих о нейтральных эффектах ингибиторов натрий-глюкозного котранспортера 2-го типа (иНГЛТ-2) в отношении фатальных, нефатальных инсультов, а также относительно влияния на частоту развития инсультов в целом, наблюдаются различия во влиянии препаратов на частоту различных подтипов инсультов.
- В мета-анализе 2021 г. показано, что терапия ни одним из исследуемых иНГЛТ-2 не приводит к уменьшению частоты ишемического инсульта и транзиторных ишемических атак, однако терапия канаглифлозином (КАНА) в исследовании CANVAS вызвала снижение риска геморрагического инсульта (RR = 0,434, 95 % CI 0,207–0,912, p = 0,027) [21]. Примечательно, что терапия КАНА достоверно уменьшала риск инсульта у пациентов с СД2 и снижением скорости клубочковой фильтрации (СКФ) менее 45 мл/мин ∙ 1,73 м2 по результатам апостериорного анализа исследований CANVAS и CREDENCE, достоверно не влияя на риск инсульта у пациентов с сохранной СКФ.
- Результаты мета-анализа 2021 г. показали, что применение иНГЛТ-2 ассоциировано со снижением риска фибрилляции предсердий на 18 % (RR = 0,82, 95% CI 0,70–0,96) и закономерно сопровождается уменьшением риска кардио-эмболического подтипа ишемического инсульта на 68 % (RR = 0,32, 95 % CI 0,12–0,85) по сравнению с плацебо.
Разработаны препараты для лечения моногенных форм ожирения. Начато исследование IIb фазы (Trial Id: NCT05198362) по изучению эффективности и безопасности препарата Tesomet – фиксированной комбинации ингибитора обратного захвата моноаминов (tesofensine) и β-1-селективного блокатора (metoprolol) при лечении гипоталамического ожирения в рамках синдрома Прадера – Вилли.
- К сожалению, исследование препарата было приостановлено в октябре 2021 г. компанией-производителем Saniona в связи с ограниченным финансированием.
При таких орфанных синдромах, характеризующихся гиперфагией, как синдромы Альстрема и Барде – Бидля, перспективно использование сетмеланотида – вещества, восстанавливающего нарушенную работу рецептора меланокортина (MC4R).
- Проведено многоцентровое рандомизированное 52-недельное исследование III фазы этого препарата (ClinicalTrials.gov, NCT03746522). Препарат обеспечил хорошее снижение массы тела у детей с синдромами Барде – Бидля, но при синдроме Альстрема эффективность препарата доказать не удалось.
Важность лечения ожирения, в том числе не только распространенного экзогенно-конституционального, но и орфанных, моногенных форм, трудно переоценить. Поэтому важной инновацией в изменении структуры эндокринологической службы в стране стало создание особого Центра лечения ожирения на базе ГНЦ ФГБУ «НМИЦ эндокринологии» Минздрава России.
2
Нейроэндокринология
В течение последних лет ведутся активные исследования, направленные на расшифровку молекулярных характеристик нейроэндокринных опухолей (НЭО) гипофиза (PitNET). Полученные данные представляют особый интерес, так как открывают возможности для персонализированной терапии.
Соматотропиномы являются наиболее часто встречающимися функционирующими НЭО гипофиза.
Соматотропиномы являются наиболее часто встречающимися функционирующими НЭО гипофиза.
- Нейрохирургию считают первой линией лечения этого заболевания, но она позволяет достичь ремиссии только у половины пациентов.
- При неэффективности хирургического лечения используют медикаментозную терапию; в большинстве случаев препаратами выбора являются аналоги соматостатина (АС) первого поколения, однако, по данным проспективных исследований, контроль заболевания достигается только в 30–40 % случаев.
В ряде случаев применение АС первого поколения ограничивает не только недостаточная эффективность, но и необходимость парентерального введения препаратов, что нередко доставляет дискомфорт пациенту и, учитывая необходимость длительного введения, влияет на качество жизни.
Также известно, что АС могут оказавать неблагоприятное влияние на углеводный обмен, что приводит к ограничениям в их использовании, особенно у больных с плохо компенсируемым сахарным диабетом. Все это стало поводом для создания новых форм АС первого поколения и молекул, оказывающих эффект, подобный действию АС.
Одним из таких препаратов является палтусотин (Paltusotine) – представитель принципиально нового класса оральных селективных небелковых (не-пептидных) агонистов соматостатиновых рецепторов 2-го типа, разработанный фармацевтической компанией Сrinetics.
В настоящее время препарат находится во второй фазе как препарат для лечения карциноидного синдрома (NCT05361668). Исследования последних лет также направлены на создание прогностических шкал или моделей предикции ответа на терапию АС первого поколения.
Также известно, что АС могут оказавать неблагоприятное влияние на углеводный обмен, что приводит к ограничениям в их использовании, особенно у больных с плохо компенсируемым сахарным диабетом. Все это стало поводом для создания новых форм АС первого поколения и молекул, оказывающих эффект, подобный действию АС.
Одним из таких препаратов является палтусотин (Paltusotine) – представитель принципиально нового класса оральных селективных небелковых (не-пептидных) агонистов соматостатиновых рецепторов 2-го типа, разработанный фармацевтической компанией Сrinetics.
- В исследованиях второй фазы получены данные об эффективности и безопасности применения этого препарата у больных акромегалией.
- В сентябре 2023 г. объявлено о завершении исследования палтусотина третьей фазы PATHFNDR-1(NCT04837040), которое подтвердило эти результаты.
- В 2024 г. планируется завершить еще одно исследование третьей фазы PATHFNDR-2 (NCT05192382).
В настоящее время препарат находится во второй фазе как препарат для лечения карциноидного синдрома (NCT05361668). Исследования последних лет также направлены на создание прогностических шкал или моделей предикции ответа на терапию АС первого поколения.
- Так исследователями из Бразилии на основе машинного обучения разработана модель предикции ответа на терапию АС первого поколения при лечении акромегалии.
- Эта модель включает данные о поле пациента, возрасте на момент диагностики заболевания, уровнях гормона роста и инсулиноподобного фактора роста-1, данные об экспрессии соматостатиновых рецепторов 2 и 5-го типов в соматотропиномах, а также о паттернах грануляции цитокератина (плотно- или редкогранулированные).
- Точность модели оказалась 86,3 %, положительная прогностическая ценность 83,3 % и отрицательная прогностическая ценность 87,5 %.
Несмотря на активный поиск, в настоящее время отсутствуют новые опухоль-ориентированные препараты для лечения НЭО гипофиза, секретирующих адренокортикотропный гормон.
- Тем важнее исследования, закончившиеся в 2022 г., полученные результаты которых в ближайшем будущем могут изменить нашу практику лечения больных гиперкортицизмом.
- В первую очередь это относится к препарату осилдростат (торговое название «истуриса»), ингибитору 11-бета-гидроксилазы, отличающемуся от разрешенного ЕМА и используемого в течение более 50 лет препарата метопирон (метирапон) большей продолжительностью действия и меньшим количеством побочных эффектов.
- В 2022 г. опубликованы результаты двух многоцентровых исследований, подтвердивших высокую эффективность препарата, позволившую на сегодняшний день рекомендовать этот ингибитор стероидогенеза ЕМА и FDA при лечении всех форм гиперкортизолизма, если не достигнуто излечение хирургическим путем.
Постоянно расширяется использование, особенно в сфере нейроэндокринологии и онкоэндокринологии, пептидов как носителей радиоактивной метки с двойным применением – тераностиков, т.е. препаратов, используемых с диагностической и лечебной целью.
Потенциальный переворот в диагностике кортикотропином, позволяющий уточнять и латерализацию, может достигаться при проведении ПЭТ/КТ с использованием меченного галлием кортиколиберина 68Ga CRH.
Потенциальный переворот в диагностике кортикотропином, позволяющий уточнять и латерализацию, может достигаться при проведении ПЭТ/КТ с использованием меченного галлием кортиколиберина 68Ga CRH.
- Из 24 наблюдений в 100 % случаев была получена идентификация кортикотропином, причем даже не выявляемых на МРТ. Дополнительное наложение изображения ПЭТ на МРТ обеспечивало латерализацию опухоли, при этом в случаях эктопических опухолей, продуцирующих адренокортикотропный гормон (АКТГ), захвата в гипофизе не выявляли.
- Если дальнейшие исследования на большем количестве больных подтвердят эти данные, появится надежная неинвазивная альтернатива катетеризации каменистых синусов, причем с лучшими результатами.
В настоящее время наиболее широко изучаются возможности применения петидов DOTATOC и DOTATATE, являющихся аналогами соматостатина, в диагностике и лечении нейроэндокринных опухолей.
Эти пептиды, хелатированные с радиоизотопами, используемыми при позитронно эмиссионной томографии (ПЭТ), а именно Ga-68 для диагностики и Lu-177 для пептидной рецепторной радионуклидной терапии (ПРРТ), составляют так называемые тераностические пары.
Эти пептиды, хелатированные с радиоизотопами, используемыми при позитронно эмиссионной томографии (ПЭТ), а именно Ga-68 для диагностики и Lu-177 для пептидной рецепторной радионуклидной терапии (ПРРТ), составляют так называемые тераностические пары.
- По результатам исследования NETTER-1 в 2018 г. Lu-177-DOTATATE уже одобрен для лечения НЭО желудочно-кишечного тракта (ЖКТ) и поджелудочной железы (ПЖ) стадий G1 and G2.
- В настоящее время продолжаются исследования третьей фазы препаратов Lu-177-DOTATATE (NETTER-2, NCT03972488) и Lu-177-Edotreotide (DOTATOC) (COMPOSE, NCT04919226) при лечении НЭО ЖКТ и ПЖ стадий G2 и G3.
С учетом того, что не все НЭО экспрессируют большое количество соматостатиновых рецепторов 2-го типа (ССР2), ведется разработка антагонистов этих рецепторов, которые обладают большей связывающей способностью с опухолевыми клетками по сравнению с агонистами ССР2, и являются новыми кандидатами для формирования тераностических пар.
Также создаются новые радиоизотопы для лечения НЭО, например, Tb-161(тербиум-161).
Таким образом, многообразие радиоизотопов и пептидов, применяемых и разрабатываемых для тераностики НЭО, позволит реализовать персонализированный подход к лечению НЭО различных локализаций и различными особенностями экспрессии соматостатиновых рецепторов.
Также создаются новые радиоизотопы для лечения НЭО, например, Tb-161(тербиум-161).
Таким образом, многообразие радиоизотопов и пептидов, применяемых и разрабатываемых для тераностики НЭО, позволит реализовать персонализированный подход к лечению НЭО различных локализаций и различными особенностями экспрессии соматостатиновых рецепторов.
3
Клиническая эндокринология
Активно внедряются в практику антитела к фрагментам клеток или клеточным рецепторам, а также селективные рецепторные модуляторы.
Важным оказался успех антитела к рецептору инсулиноподобного фактора роста 1-го типа, тепротумумаба в лечении эндокринной офтальмопатии и, как выяснилось позже, претибиальной микседемы. R. Crespo-Trevino и соавторы доказали эффективность п
репарата и при этом ассоциированном с болезнью Грейвса аутоиммунном поражении.
Важным оказался успех антитела к рецептору инсулиноподобного фактора роста 1-го типа, тепротумумаба в лечении эндокринной офтальмопатии и, как выяснилось позже, претибиальной микседемы. R. Crespo-Trevino и соавторы доказали эффективность п
репарата и при этом ассоциированном с болезнью Грейвса аутоиммунном поражении.
В 2022 г. опубликованы работы, потенциально способные изменить лечение классических форм врожденной дисфункции коры надпочечников (ВДКН), при которой соблюдение баланса между подавлением продукции андрогенов, достижимым только на супрафизиологических дозах глюкостероидов, и отсутствием передозировки стероидов далеко не всегда возможно, особенно у взрослых.
К настоящему времени несколько молекул доказали потенциальную эффективность – Tildacerfont, предложенный для лечения взрослых. По данным K. Sarafoglou и соавторов, этот нестероидный антагонист рецептора 1-го типа к кортиколиберину обладает высокой связывающей активностью и активно снижает секрецию АКТГ, что позволяет у лиц с ВДКН снизить продукцию предшественников надпочечниковых андрогенов.
К настоящему времени несколько молекул доказали потенциальную эффективность – Tildacerfont, предложенный для лечения взрослых. По данным K. Sarafoglou и соавторов, этот нестероидный антагонист рецептора 1-го типа к кортиколиберину обладает высокой связывающей активностью и активно снижает секрецию АКТГ, что позволяет у лиц с ВДКН снизить продукцию предшественников надпочечниковых андрогенов.
- Это уже вторая попытка выпустить подобные молекулы, и на основании двух законченных исследований (NCTJ03257464 и NCT03687242) получены данные о снижении продукции АКТГ, андростендиона и 17-оксипрогестерона при хорошей переносимости препарата. Вопросы оптимальной биодоступности этого липофильного препарата, как и оптимальных дозировок, станут предметом дальнейших исследований.
Разработан препарат Macimorelin – синтетический агонист рецептора к грелину для тестов на секрецию соматотропного гормона, прирост оценивается при пероральном приеме. Возможно, мы простимся с инсулиновой гипогликемией как тестом в поисках дефицита гормона роста. Впрочем, стоимость этого препарата сегодня так велика, что радость по поводу его появления может быть преждевременной.
Для усовершенствования диагностики эктопированных и множественных аденом околощитовидных желез у больных первичным гиперпаратиреозом (ПГПТ) в настоящее время в мире предложено использование ПЭТ/КТ с 11С-метионином или холином.
Расширение показаний для этого метода с включением больных ПГПТ позволяет улучшить диагностику, повысить эффективность оперативного лечения и обеспечить лучший прогноз заболевания. Данная методика в 2021–2023 гг. активно используется и в РФ.
Расширение показаний для этого метода с включением больных ПГПТ позволяет улучшить диагностику, повысить эффективность оперативного лечения и обеспечить лучший прогноз заболевания. Данная методика в 2021–2023 гг. активно используется и в РФ.
Лечение ахондроплазии не входит в функцию эндокринолога в нашей стране, тем не менее многим врачам будет интересно сообщение, что FDA разрешило препарат Vosoritide (Voxzogo), вводимый ежедневно в виде инъекций, для лечения детей с этим заболеванием в возрасте от пяти лет с открытыми зонами роста. Генетически детерминированное заболевание, ахондроплазия, связано с аномалиями энхондрального окостенения, блокатором которого является СNP, натрийуретический пептид. По химической структуре Vosoritide является аналогом CNP, и его применение позволяет улучшить ростовой прогноз.
Locke A.E., Kahali B., Berndt S.I. et al. Genetic studies of body mass index yield new insights for obesity biology //Nature. 2015;518:197–206. DOI: 10.1038/nature14177
Khera A.V., Chaffin M., Wade K.H. et al. Polygenic prediction of weight and obesity trajectories from birth to adulthood // Cell. 2019;177:587–596.e9. DOI: 10.1016/j.cell.2019.03.028
Khera A.V., Chaffin M., Wade K.H. et al.Polygenic prediction of weight and obesity trajectories from birth to adulthood // Cell.2019;177:587–596.e9. DOI: 10.1016/j.cell.2019.03.028
Murthy V.L., Xia R., Baldridge A.S. et al.Polygenic risk, fitness, and obesity in the coronary artery risk development in young adults (CARDIA) study // JAMA Cardiol.2020;5:40–48.
Murthy V.L., Xia R., Baldridge A.S. et al.Polygenic risk, fitness, and obesity in the coronary artery risk development in young adults (CARDIA) study // JAMA Cardiol.2020;5:40–48.
Tremblay J., Haloui M., Attaoua R. et al. Polygenic risk scores predict diabetes complications and their response to intensive blood pressure and glucose control // Diabetologia. 2021;64:2012–2025. DOI: 10.1007/s00125-021-05491-7
Rosenberg N.A., Edge M.D., Pritchard J.K., Feldman M.W. Interpreting polygenic scores, polygenic adaptation, and human phenotypic differences // Evol Med Public Heal. 2019;1:26–34. DOI: 10.1093/emph/eoy036
He Y., Lakhani C.M., Rasooly D. et al. Comparisons of polyexposure, polygenic, and clinical risk scores in risk prediction of type 2 diabetes // Diabetes Care. 2021;44:935–943. DOI: 10.2337/dc20-2049
He Y., Lakhani C.M., Rasooly D. et al. Comparisons of polyexposure, polygenic, and clinical risk scores in risk prediction of type 2 diabetes // Diabetes Care. 2021;44:935–943. DOI: 10.2337/dc20-2049
Mars N., Koskela J.T., Ripatti P. et al. Polygenic and clinical risk scores and their impact on age at onset and prediction of cardiometabolic diseases and common cancers // Nat Med.2020;26:549–557. DOI: 10. 1038/s41591-020-0800-0
Mars N., Koskela J.T., Ripatti P. et al. Polygenic and clinical risk scores and their impact on age at onset and prediction of cardiometabolic diseases and common cancers // Nat Med.2020;26:549–557. DOI: 10. 1038/s41591-020-0800-0
Raal F.J., Kallend D., Ray K.K. et al. Inclisiran for the treatment of heterozygous familial hypercholesterolemia // N Engl J Med. 2020;382(16):1520-1530. DOI: 10.1056/NEJMoa1913805
Ray K.K., Wright R.S., Kallend D. et al. Two Phase 3 Trials of Inclisiran in patients with elevated LDL cholesterol // N Engl J Med. 2020;382(16):1507-1519. DOI: 10.1056/NEJMoa1912387
Hirsch J.S. FDA approves teplizumab: a milestone in type 1 diabetes // Lancet Diabetes Endocrinol. 2023;11(1):18. DOI: 10.1016/S2213-8587(22)00351-5
Rosenstock J., Wysham C., Frías J.P. et al. Efficacy and safety of a novel dual GIP and GLP-1 receptor agonist tirzepatide in patients with type 2 diabetes (SURPASS-1): a double-blind, randomised, phase 3 trial // Lancet. 2021;398(10295):143-155. DOI: 10.1016/S0140-6736(21)01324-6
Agarwal R., Filippatos G., Pitt B. et al. Cardiovascular and kidney outcomes with finerenone in patients with type 2 diabetes and chronic kidney disease: FIDELITY pooled analysis // EurHeart J. 2022;43(6):474-484. DOI: 10.1093/eurheartj/ehab777
González-Juanatey J.R., Górriz J.L., Ortiz A. et al. Cardiorenal benefits of finerenone: protecting kidney and heart // Ann Med. 2023;55(1):502-513. DOI: 10.1080/07853890.2023.2171110
Tsai W.H., Chuang S.M., Liu S.C. et al. Effects of SGLT2 inhibitors on stroke and its subtypes in patients with type 2 diabetes: a systematic review and meta-analysis // Scient Rep. 2021.11(1):15364. DOI: 10.1038/s41598-021-94945-4
Li H.L., Lip G., Feng Q. et al. Sodium-glucose cotransporter 2 inhibitors (SGLT2i) and cardiac arrhythmias: a systematic review and meta-analysis // Cardiovasc Diabetol. 2021; 20(1): 100. DOI: 10.1186/s12933-021-01293-8
Haqq A.M., Chung W.K., Dollfus H. et al. Efficacy and safety of setmelanotide, a melanocortin-4 receptor agonist, in patients with Bardet-Biedl syndrome and Alström syndrome: a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial with an open-label period // Lancet Diabetes Endocrinol. 2022;10(12):859-868. DOI: 10.1016/S2213-8587(22)00277-7
Gadelha M., Bex M., Feelders R.A. et al. Randomized trial of osilodrostat for the treatment of cushing disease // J Clin Endocrinol Metab. 2022;107(7):e2882-e2895. DOI: 10.1210/clinem/dgac178
Fleseriu M., Newell-Price J., Pivonello R. et al. Long-term outcomes of osilodrostat in Cushing’s disease: LINC 3 study extension // Eur J Endocrinol. 2022;187(4):531-541. DOI: 10.1530/EJE-22-0317
Fleseriu M., Newell-Price J., Pivonello R. et al. Long-term outcomes of osilodrostat in Cushing’s disease: LINC 3 study extension // Eur J Endocrinol. 2022;187(4):531-541. DOI: 10.1530/EJE-22-0317
Fleseriu M., Newell-Price J., Pivonello R. et al. Long-term outcomes of osilodrostat in Cushing’s disease: LINC 3 study extension // Eur J Endocrinol. 2022;187(4):531-541. DOI: 10.1530/EJE-22-0317
Walia R., Gupta R., Bhansali A. et al. Molecular imaging targeting corticotropin-releasing hormone receptor for corticotropinoma: a changing paradigm // J Clin Endocrinol Metab. 2021;106(4):1816-1826. DOI: 10.1210/clinem/dgaa755
Crespo-Trevino R., Schiffman J., Ugradar S. et al. Thyroid dermopathy responds to teprotumumab therapy // Endocrinol Diabetes Metab Case Reports. 2022;2022(10295):143-155. DOI: 10.1530/EDM-21-0201
Sarafoglou K., Barnes C.N., Huang M. et al. Tildacerfont in adults with classic congenital adrenal hyperplasia: results from two phase 2 studies // J Clin Endocrinol Metab. 2021;106(11):e4666-e4679. DOI: 10.1210/clinem/dgab438
Auchus R.J., Sarafoglou K., Fechner P.Y. et al. Crinecerfont lowers elevated hormone markers in adults with 21-hydroxylase deficiency congenital adrenal hyperplasia // J Clin Endocrinol Metab. 2022;107(3):801-812. DOI: 10.1210/clinem/dgab749
Зарегистрированные в мире лекарственные препараты или изделия, которые внедрены в практику и имеют персонализированные показания к применению
Тирзепатид (Mounjaro™)
– новый препарат, двойной агонист рецепторов глюкагоноподобного пептида 1-го типа и глюкозозависимого инсулинотропного полипептида (одобрен в мае 2022 г. FDA (США) для подкожных инъекций один раз в неделю для контроля гликемии).
На сегодняшний день этот препарат является непревзойденным по эффективности средством для лечения СД2 в сочетании с ожирением. В 2023 г. планируется ускоренное рассмотрение FDA нового показания для этого препарата, а именно лечение ожирения без сопутствующего СД2.
Финеренон
– первый представитель нового класса препаратов, нестероидный антагонист минералокортикоидных рецепторов (МКР) зарегистрирован в 2022 г. в США и Европе для лечения пациентов с СД2 и хронической болезнью почек, который в серии рандомизированных клинических исследований (FIDELIO-DKD и FIGARO-DKD, объединенных в программу FIDELITY) доказал высокую эффективность в качестве кардионефропротектора.
Осилдростат
– ингибитор 11-бета-гидроксилазы, одобрен ЕМА и FDA для лечения всех форм гиперкортизолизма.
Меченный галлием кортиколиберин (68Ga CRH)
– тераностик в области нейро- и онкоэндокринологии.
Палтусотин
– оральный селективных небелковый (не-пептидный) агонист соматостатиновых рецепторов 2, разработан для лечения акромегалии и карциноидного синдрома.
Tesofensine +metoprolol (Tesomet)
– комбинация ингибитора обратного захвата моноаминов и β-1-селективного блокатора для лечения синдрома Прадера – Вилли.
Сетмеланотид
– комбинация ингибитора обратного захвата моноаминов и β-1-селективного блокатора для лечения синдрома Прадера – Вилли.
Tildacerfont и Crinecerfont
– лечение классических форм врожденной дисфункции коры надпочечников (ВДКН).
Основные достижения российской науки и индустрии за последние годы
В НМИЦ эндокринологии МЗ РФ (Москва) реализуются следующие направления:
- создание на базе регистра эндокринопатий аналитической системы прогнозирования развития осложнений и исходов течения эндокринных заболеваний с использованием наукоемких алгоритмов диагностики ИИ и анализа больших данных;
- разработка прогрессивных технологий для персонализированной диагностики эндокринных и онкоэндокринных заболеваний на основе разрабатываемой с помощью системы ИИ платформы, объединяющей клинико-катамнестические, геномные, метаболомные и иммуногистохимические параметры;
- разработка прогрессивных методов терапии эндокринных и онкоэндокринных патологий на основе современных радионуклеидных, генетических и клеточных технологий.
Достигнуты следующие результаты:
- Модуль ИАСРазработан модуль ИАС, который обеспечивает логистический контроль и прозрачность многостадийной обработки образцов. Повышение качества и бесперебойности лабораторных процессов.
Благодаря автоматизации приема, рутинной обработки и хранения данных высвобождаются человеческие ресурсы, упрощается коммуникация между сотрудниками, а также повышается оперативность и бесперебойность лабораторных процессов.
Программное обеспечение, разработанное в рамках данного проекта, позволяет поточно анализировать точечные замены и короткие вставки/делеции в герминальных генетических данных (панели генов, результаты полноэкзомного и полногеномного анализа). Доступны инструменты аннотации, фильтрации и предсказания патогенности, что облегчает решение научных и диагностических задач по поиску и приоритизации молекулярно-генетических вариантов с учетом фенотипа.
Готовится заявка «программы для электронных вычислительных машин (программы для ЭВМ)». - Логистика коллекции гистологических препаратовПереработана логистика коллекции гистологических препаратов для автоматизации внесения информации об образцах в единый регистр; добавлено штрихкодирование гистологических стекол 2D-штрих-кодом (datamatrix), содержащим информацию об уникальном идентификаторе исследования и номере гистологического стекла.
Коллекция изображений гистологических стекол продолжает пополняться новыми изображениями (40 000 образцов). Данный регистр интегрирован в прототип ИАС НЦМУ, где объединен с данными генетической диагностики путем стыковки по единым идентификаторам пациента из медицинской информационной системы.
Готовятся две заявки на «программы для электронных вычислительных машин (программы для ЭВМ)» и «база данных». - Разработка системы прогнозирования гипокальцемииРазработаны системы прогнозирования гипокальцемии на 1–3 сут после паратиреоидэктомии при ПГПТ и нарушения функции почек после паратттиреоидэктомии.
Поданы две заявки на патенты от 02.05.2023 (№ 2023111350 и 2023111351). - Разработка и первичная клиническая валидация нескольких тест-систем для выявления различных геновПроведена разработка и первичная клиническая валидация нескольких тест-систем (ПЦР):
- для выявления мутации в гене RET (медуллярный рак щитовидной железы (ЩЖ)),
- мутаций в гене CYP21A2 (врожденная дисфункция коры надпочечников),
- сиквенс-системы по анализу 378 генов для диагностики наследственных эндокринопатий,
- тест-системы для выявления генных транслокаций при раке ЩЖ;
- хромато-масс-спектрометрии уровня стероидов в сухих пятнах крови, набора для гормонального стероидного профилирования крови хромато-масс-спектрометрическим методом.
- Продолжается изучение факторов и механизмов повреждения β-клеток при СД2 в эксперименте (в качестве критерия – показатели НОМА-%В/ИИ).
- Изучение связи риска развития СД2 и этнического происхожденияИзучается связь риска развития СД2 и этнического происхождения. Исследование генетических маркеров СД2 в различных этнических группах населения, наряду с анализом влияния факторов внешней среды, позволит выявить этнические особенности развития заболевания, определить потенциальные терапевтические мишени для разработки лекарственных препаратов и разработать персонифицированный подход к профилактике и лечению данной патологии.
- Изучение полиморфизма генов, определяющих индивидуальные особенности метаболизма сахароснижающих препаратов.Продолжается изучение полиморфизма генов, определяющих индивидуальные особенности метаболизма сахароснижающих препаратов. На выборке из 450 пациентов определены частоты полиморфизмов генов: для метформина шесть вариантов для двух генов; сульфонилмочевины – четыре варианта для трех генов; агонистов рецепторов глюкагоноподобного пептида – 1-2 варианта одного гена.
- Проведено исследование поражений эндокринных органов у 169 пациентов, получивших лечение ингибиторами контрольных точек иммунного ответа (ИКТИО).
У 12 % выявлена дисфункция щитовидной железы. Даны рекомендации пациентам, получающим ИКТИО на фоне аутоиммунного гипотиреоза. Готовится заявка на «полезную модель». - Проведен анализ экспрессии М2 изоформы пируваткиназы РКМ – мишени DASA – ПЭТ-трейсеров у 45 пациентов с опухолями ЩЖ.Полученный результат позволяет дифферинцировать доброкачественные и злокачественные новообразования неинвазивно. Готовится заявка на «полезную модель».
- Выполнена дифференцировка СК с мономутацией в гене MEN 1 и без мутации (контроль) в клетки-прекурсоры паращитовидной железы, адипоциты и остеобласты.
Отредактирована мутация в последних двух с помощью CRISPR/Cas9 Prime editing (редактирование генома с целью создания новых методов лечения моногенных эндокринопатий). - Подана заявка на патент «Прогнозирование риска вторичной обтурации слезного протока при назначении радиойодтерапии по сцинтиграфическим изображениям».
- Изучены химерные серотипы ААВ-DJ и ААВ -DJ/8 с высокой трансдукцией клеток печени и надпочечников.
- Начаты исследования в области разработки прототипов лекарственных препаратов для лечения эндокринопатий и онкоэндокринных патологий с использованием клеточных технологий.
В НМИЦ им. В.А. Алмазова:
- Идентифицированы персонифицированные предикторы ответа на терапию антидиабетическими препаратами при сахарном диабете, в рамках экспериментального исследования продолжается изучение нейро- и остеотропных свойств сахароснижающих препаратов.
Получен патент «Способ экспериментального моделирования сахарного диабета 2-го типа в сочетании с менопаузой у самок крыс стока Wistar» № 2022133307/14(072552) (01.08.2023). - Проведение клэмп-исследований и исследований по иммуногенности способствовало выводу на рынок линейки отечественных биосимиляров аналогов инсулинов различной продолжительности действия.
- Разработаны математические модели и автоматизированные системы поддержки принятия решений для выбора тактики ведения больных с сердечно-сосудистой патологией и тиреотоксикозом различного генеза.
- Оптимизирована тактика ведения и профилактика неблагоприятных исходов у беременных с нарушениями функции щитовидной железы.
- Определены механизмы нарушений пубертатного развития и мужского гипогонадотропного гипогонадизма и разработаны новые подходы к лечению и профилактики, предложен новый лекарственный препарат на основе новых технологий для лечения мужского гипогонадизма.
- Разработан новый лекарственный препарат для лечения и профилактики сенильного и постменопаузального остеопороза.
- Определены долгосрочные эффекты дефицита витамина D, разработан персонифицированный подход к его профилактике и терапии.
Дополнительно в НЦМУ «Центр персонализированной медицины» НМИЦ им. В.А. Алмазова:
- Определены предикторы развития гестационного сахарного диабета, включая молекулярно-генетические, и оценено их влияние на плод.
- Разработана рекомендательная система (мобильное приложение) ДиаКомпаньон для пациенток с гестационным сахарным диабетом (ГСД) на диете.
Разработаны модели прогнозирования ППГО с применением методов машинного обучения. Встроенная в приложение модель прогнозирует какой будет уровень глюкозы в крови у женщины с ГСД после конкретного приема пищи, и, в случае прогнозирования высокого уровня, оценивает причины повышения и демонстрирует рекомендации по питанию для предотвращения гипергликемии. Получены три свидетельства о государственной регистрации программ для ЭВМ (№ 2022664462, 2022661781 и 2021681059). Готовится досье для подачи заявки на регистрацию медицинского изделия. - С использованием GWAS выявлены генетические маркеры динамики веса у пациентов с нарушениями углеводного обмена и ожирением, интегрированы в предсказательную модель.
- Уточнены молекулярно-генетические пути развития ожирения и реализации ответа на его медикаментозное и хирургическое лечение, выявлены молекулярно-генетические, гормональные и поведенческие предикторы эффективности терапии ожирения арГПП1 и редуксином, идентифицированы новые гормональные (чувствительность к грелину) и молекулярно-генетические (экспрессия CCl2, Hif1a, miR-142 в жировой ткани) маркеры метаболического здоровья.
- Разработаны новые методы диагностики нейроэндокринных опухолей гипофиза, поджелудочной железы, мозгового слоя надпочечников, околощитовидных желез, внедрены в клиническую практику ПЭТ/КТ с 11С-метионином и холином для диагностического поиска эктопированных и множественных аденом околощитовидных желез при ПГПТ.
- Определены предикторы ремиссии болезни Кушинга после транссфеноидальной аденомэктомии.
- Путем полноэкзомного секвенирования выявлены новые герминальные мутации, ответственные за развитие нейроэндокринных опухолей поджелудочной железы, надпочечников и околощитовидных желез.
- Создана база больных, перенесших COVID-19 средней и тяжелой степени, для динамического наблюдения за развитием нарушений со стороны эндокринной системы, проведена морфологическая оценка поджелудочной железы и щитовидной железы больных в острый период новой коронавирусной инфекции.
Достижение других центров:
Сотрудниками Института экспериментальной медицины (Санкт-Петербург) разработан метод выделения аутопробиотических энтерококков, применение которых при метаболическом синдроме было изучено совместно с сотрудниками НМИЦ им. В.А. Алмазова в рамках НЦМУ «Центр персонализированной медицины». В рандомизированном исследовании показаны преимущества использования аутопробиотических энтерококков при ожирении и нарушении толерантности к глюкозе в виде снижения гликемии натощак и уровня гликозилированного гемоглобина.
В Приволжском исследовательском медицинском университете (Нижний Новгород) выполняется разработка технологии инкапсуляции островков поджелудочной железы для компенсации абсолютных инсулин-дефицитных состояний. Разработана и сконструирована лабораторная установка по синтезу микрокапсул из альгинатного композита методом микрофлюидики (совместно с ИМХ РАН, Нижний Новгород). Разработана методика инкапсуляции островков Лангерганса поджелудочной железы. Проведена in vitro и in vivo оценка безопасности и стабильности альгинатной микрокапсулы, ее влияния на жизнеспособность и функциональную активность островков Лангерганса.
В НИИКЭЛ (филиал ИЦиГ СО РАН, Новосибирск) разработан метод персонализированного прогноза эпизодов гипогликемии и гипергликемии у больных сахарным диабетом 1-го типа на основе алгоритмов машинного обучения. Также разработана технология идентификации паттернов гликемии, основанная на кластерном анализе данных непрерывного мониторинга глюкозы, для персонификации инсулинотерапии у больных сахарным диабетом 1-го типа.
В ФИЦ «Институт цитологии и генетики сибирского отделения» Российской академии наук изучены молекулярно-генетические факторы риска развития нарушений углеводного и липидного обмена при моногенных формах заболеваний с помощью технологии секвенирования нового поколения. Определены редкие варианты в генах аполипопротеинов: APOB, APOE, APOC3 у пациентов с фенотипом СГХС и коронарным атеросклерозом. Разработана таргетная панель для диагностики моногенных форм сахарного диабета.
В ФМИЦ глазных болезней имени Геймгольца разработан доступный способ определения факторов риска развития диабетического макулярного отека (ДМО) за счет определения в СК содержания брадикинина (БК) и аденозин-превращающего фермента (АПФ) и их соотношения. На основе обучения нейронной сети ResNet50 создана система для распознавания признаков ДР по фундус-снимкам.
В ФМИЦ терапии и профилактической медицины в нозологических и популяционной выборках (n = 796) проводится апробация разработанной диагностической панели для оценки риска развития ожирения и сахарного диабета 2-го типа (СД2), включающей как гены, ответственные за развитие моногенных форм указанных заболеваний, так и шкалы генетического риска, разработанные на основе результатов исследований полногеномных ассоциаций. Создан промышленный образец тест-системы для определения носительства частых вариантов нуклеотидной последовательности, связанных с развитием аутосомно-рецессивных заболеваний: муковисцидоз, фенилкетонурия, нейросенсорная тугоухость и дефицит альфа-антитрипсина.
В ФГБУ «Центр стратегического планирования и управления медико-биологическими рисками здоровью» выполняется разработка и доклиническое исследование готовой лекарственной формы (ГЛФ) на основе вещества N-пентилрезорцинола, которое проявляет свойства видонеспецифического регулятора систем Quorum Sensing (QS) микробиоты кишечника, для модуляции эндокринной и метаболической функций жировой ткани.
В Курском государственном медицинском университете проведен анализ системной вовлеченности и совокупного вклада полиморфных вариантов генов ответа на неупакованные белки в молекулярные механизмы развития сахарного диабета 2-го типа и его прогрессирование, установлены ассоциации генотипов rs1882019-A/A HSP90B1 и rs1046495-T/C GFER с пониженным риском развития диабета, а минорных аллелей rs1043618-С HSPA1A и rs196914-C ERN1 – с повышенным, независимо от пола, возраста и ИМТ пациентов. У женщин протективным эффектом также обладал генотип rs899997-T/G SLCO1B1, а генотипы rs10778306-A/G HSP90B1, rs3095154-G/A HSPA1A и rs7838717-T/T HSF1 определяли повышенный риск. Полученные результаты будут использованы для создания диагностической панели, позволяющей выявить предрасположенность к заболеванию на доклинической стадии, а также для разработки программы персонализированного лечения пациентов с сахарным диабетом 2-го типа.
В Ростовском государственном медицинском университете выявлены гормонально-метаболические и иммунологические маркеры формирования нарушений пубертата у подростков с ожирением в условиях неблагоприятной экологической ситуации, оптимизирована их диагностика и терапия.
В Санкт-Петербургском государственном университете разработаны новые методы отслеживания нейропатии малых волокон и получены новые знания о патогенезе их поражения при постковидном синдроме.
В Сибирском государственном медицинском университете сформирована шкала факторов риска развития саркопении, при этом наиболее значимыми из них оказались: висцеральное ожирение, сахарный диабет, отсутствие приема витамина D в репродуктивном периоде, гиподинамия, неалкогольная жировая болезнь печени, гипотиреоз в настоящее время или в анамнезе. Выполняется разработка программы профилактики и реабилитации снижения мышечной массы для пациентов из группы риска.
Сотрудниками Российской медицинской академии непрерывного профессионального образования МЗ РФ установлено, что молекулярно-генетическое тестирование цитологических препаратов с заключением Bethesda IV с помощью отечественного молекулярно-генетического классификатора, разработанного в ИМКБ СО РАН (тест ТиройдИНФО), может с высокой точностью различать злокачественные и доброкачественные узлы щитовидной железы полученному при ТАБ узла щитовидной железы. Внедрение результатов исследования в клиническую практику позволит значительно уменьшить количество диагностических операций при узловых образованиях щитовидной железы.
В Северо-Западном государственном медицинском университете имени И.И. Мечникова МЗ РФ продолжаются успешные исследования по оценке метода газовой хромато-масс-спектрометрии (ГХ-МС ГХ-МС) в диагностике рецидива адренокортикального рака (АКР) и выявлении ранних признаков злокачественности опухолей у больных неклассической формой врожденной дисфункции коры надпочечников (НФ ВДКН) вследствие дефекта 21-гидроксилазы в сочетании с образованием коры надпочечников. Полученные результаты убедительно показывают, что ГХ-МС позволяет обнаружить признаки рецидива АКР после операции, а также ранние признаки малигнизации у больных НФ ВДКН вследствие дефекта 21-гидроксилазы в сочетании с образованиями коры надпочечников.
Ученые Федерального исследовательского центра комплексного изучения Арктики имени академика Н.П. Лаверова Уральского отделения РАН, изучая фотопериодическую зависимость физиологических эффектов дофамина на функциональную активность систем гипофиз – щитовидная железа и гипофиз – гонады у жителей арктических территорий, обнаружили различные соотношения уровней дофамина и содержания гормонов, белков и аутоантител системы гипофиз – щитовидная железа в крови в разные фотопериоды года у практически здоровых лиц, проживающих на территории АЗРФ. Результаты позволяли выявить значимые фотопериоды года для проведения диагностических и превентивных мер, направленных на предотвращение риска развития дезадаптационных реакций щитовидной железы. Продолжением исследования может служить выявление подобных закономерностей у женского населения, а также изучение возможного влияния дофамина на другие эндокринные звенья, в частности, систему гипофиз – гонады.
В Научно-исследовательском институте морфологии человека имени академика А.П. Авцына выполнено исследование морфогенеза и секреторной деятельности надпочечников в условиях пренатального и постнатального воздействия на организм эндокринных дисрапторов. Исследователями установлено, что воздействие низких доз ДДТ в пренатальном и постнатальном периодах онтогенеза приводит к нарушению постнатального морфогенеза и секреторной деятельности кортикостероцитов клубочковой, пучковой, сетчатой зон коркового вещества, а также хромаффинных клеток мозгового вещества. Результаты исследования не только расширяют существующие представления о механизмах действия эндокринных дисрапторов, но и устанавливают новый механизм – дисморфогенетический, что позволяет дополнить определение, данное эндокринным дисрапторам ВОЗ как экзогенных веществ, которые нарушают развитие эндокринных желез, а не только синтез, выделение, транспорт, метаболизм, связывание и выведение эндогенных гормонов, ответственных за гомеостаз, репродукцию и развитие.
Сотрудниками Научно-исследовательского института акушерства, гинекологии и репродуктологии имени Д.О. Отта разработаны диагностические критерии прогнозирования и преодоления репродуктивных потерь, что позволит создать алгоритм персонализированной диагностики причин репродуктивных потерь на разных сроках гестации и определить индивидуальный поэтапный подход к планированию и ведению супружеских пар.
Актуальность научного исследования обусловлена увеличением частоты репродуктивных потерь, что ведет к снижению показателей рождаемости в РФ, а широкое внедрение к практику стандартных общепринятых диагностических и лечебных подходов не улучшает ситуацию в целом. Целью НИР является разработка диагностических критериев прогнозирования и преодоления репродуктивных потерь. Определение диагностических критериев прогнозирования и преодоления репродуктивных потерь основывается на комплексном исследовании всех уровней организации организма как матери, так и плода. Так, изучение механизмов регуляции репродукции (от предгравидарной подготовки женщины и мужчины с целью выполнения репродуктивного потенциала, беременности с первых этапов имплантации и до родоразрешения), основывается на многоуровневом исследовании геномики, транскриптомики, протеомики и метаболомики. Данные уровни организации находятся в тесной взаимосвязи друг с другом, в них заложены все основные подходы к созданию принципиально новой медицины будущего – идентификация причин и определение нестандартных методов таргетной профилактики невынашивания беременности, что является приоритетным направлением научно-клинических исследований. Реализация планируемой фундаментальной темы позволит создать алгоритм персонализированной диагностики причин репродуктивных потерь на разных сроках гестации и определить индивидуальный поэтапный подход к планированию и ведению супружеских пар.
Актуальность научного исследования обусловлена увеличением частоты репродуктивных потерь, что ведет к снижению показателей рождаемости в РФ, а широкое внедрение к практику стандартных общепринятых диагностических и лечебных подходов не улучшает ситуацию в целом. Целью НИР является разработка диагностических критериев прогнозирования и преодоления репродуктивных потерь. Определение диагностических критериев прогнозирования и преодоления репродуктивных потерь основывается на комплексном исследовании всех уровней организации организма как матери, так и плода. Так, изучение механизмов регуляции репродукции (от предгравидарной подготовки женщины и мужчины с целью выполнения репродуктивного потенциала, беременности с первых этапов имплантации и до родоразрешения), основывается на многоуровневом исследовании геномики, транскриптомики, протеомики и метаболомики. Данные уровни организации находятся в тесной взаимосвязи друг с другом, в них заложены все основные подходы к созданию принципиально новой медицины будущего – идентификация причин и определение нестандартных методов таргетной профилактики невынашивания беременности, что является приоритетным направлением научно-клинических исследований. Реализация планируемой фундаментальной темы позволит создать алгоритм персонализированной диагностики причин репродуктивных потерь на разных сроках гестации и определить индивидуальный поэтапный подход к планированию и ведению супружеских пар.
Российские ученые активно изучают проблему мужского бесплодия. Так, исследования в Научном центре проблем здоровья семьи и репродукции человека были посвящены выявлению генетико-метаболических маркеров репродуктивных нарушений у мужчин для персонализированной коррекции и эффективной профилактики.
В Медико-генетическом научном центре имени академика Н.П. Бочкова были разработаны рекомендации по комплексному генетическому обследованию мужчин с бесплодием, а также сформирована панель из 133 генов, связанных с нарушением сперматогенеза, приводящих к мужскому бесплодию; показана эффективность комплексной диагностики с использованием геномных методов исследования.
Перечень создаваемых препаратов по направлению с указанием фазы разработки НМИЦ энокринологии:
- Клеточный препарат для лечения хронических ранРазработан прототип клеточного препарата – высокотехнологичного лекарственного препарата (соматоклеточного препарата) для лечения хронических ран, в том числе при синдроме диабетической стопы.
- Клеточный препарат состоит из мезенхимальных стромальных клеток костного мозга, является по сути суспензией живых клеток для заживления ран, который нарабатывается в асептических условиях путем культивирования с целью наработки терапевтических доз.
- Прототип проверен в доклинических и пилотных клинических исследованиях и продемонстрировал самую высокую в мире эффективность по скорости регенерации кожи при труднозаживающих диабетических язвах: язвы площадью от 4 до 40 см2 полностью эпителизировались, отсутствовали рецидивы в месте лечения после трех лет наблюдения.
- Клеточный препарат для восполнения объемных дефектов костной ткани при ее поврежденияхРазработан прототип клеточного препарата – тканеинженерной костной ткани для восполнения объемных дефектов костной ткани при ее различных повреждениях (в том числе для лечения стопы Шарко).
- Тканеинженерная костная ткань представляет собой иммобилизованные преддифференцированные живые клетки на биосовместимом материале (зарегистрированном медицинском изделии).
- Проведена доклиническая оценка применения тканеинженерной костной ткани на моделях повреждения костей у крыс, кроликов и собак.
- Прототип клеточного препарата позволяет ускорить регенерацию костной ткани в 2-2,5 раза, а также обеспечить регенерацию в практически невозможных для восстановления случаях (аваскулярные некрозы костей в единичных клинических случаях).
Предложения по перспективному планированию
Переход от унифицированной к ПМ, даже в такой быстро развивающейся области как эндокринология, займет немало времени:
Переход от унифицированной к ПМ, даже в такой быстро развивающейся области как эндокринология, займет немало времени:
- требуется усовершенствование законодательной базы, особенно в части клеточных и биомедицинских технологий,
- решение этических вопросов, в том числе по защите персональной генетической информации,
- подготовка высококвалифицированных кадров,
- наличие необходимого оборудования и расходных материалов,
- пересмотр клинических рекомендаций и протоколов лечения, реструктуризация фармацевтических производств,
- просвещение населения о возможностях нового направления.
В настоящее время ПМ стоит на пороге значительного расширения возможностей. Геномные и постгеномные технологии входят в повседневную практику. Основным препятствием в развитии персонализированной медицины наряду с пока еще высокой стоимостью необходимых исследований считают недостаточную подготовленность специалистов, большой разрыв между предоставляемыми ею новыми ценными диагностическими и терапевтическими возможностями и способностью практических врачей оценить их и применить на практике. Перечисленные факторы указывают на необходимость развития этой перспективной области в виде научных исследований по социально значимым и орфанным заболеваниям. В современных условиях интенсивного развития персонализированных биомедицинских технологий специалистам важно понимать, в чем состоят принципиальные особенности персонализированной медицины по сравнению с подходами недавнего прошлого. Медицина с самого начала стремилась к персонализации, но до расшифровки генома человека это было в большей степени мечтой, чем реальностью. Дальнейшая персонализация современной медицины, как представляется, будет развиваться по следующим основным направлениям:
- Разделение традиционных нозологических форм на молекулярные подгруппы для дифференциального подхода к лечению.
- Основанный на геномике предсказательный подход, позволяющий предупредить развитие заболевания вместо диагностики уже развернутой патологии. Геномный подход может быть совмещен с мониторингом начала заболевания посредством анализа про-теома и метаболома. Подход был проиллюстрирован мониторингом этих показателей у одного из исследователей в течение нескольких месяцев, что позволило вкупе с информацией о его геноме обнаружить у него преддиабет и скорректировать его развитие изменением образа жизни.
- Контроль эффективности лечения заболеваний и снижения степени выраженности побочных эффектов этого лечения посредством терапевтического лекарственного мониторинга.
- Организация криобанков биоматериала, связанного с социально-значимыми заболеваниями. Биобанки необходимы при разработке и валидации персонализированных подходов к диагностике заболевания. Депонирование образцов от пациента в течение всей его жизни обеспечивает персонализацию мониторинга его индивидуальных показателей; в качестве контроля используется биоматериал от этого же пациента, взятый ранее.
- «Цифровая» диагностика социально-значимых заболеваний, основанная на поиске белковых биомаркеров по принципу их присутствия (1) или отсутствия (0) в образцах больных или контрольных субъектов. Задача решается за счет обнаружения в доступном биоматериале от пациентов появления или исчезновения модифицированных ключевых белков протеома и за счет усиления чувствительности аналитических методов в протеомике.
- Персонализация клеточных технологий, в том числе применение собственных плюрипотентных и перепро-граммированных клеток для регенеративной медицины.
Неврология
Основные направления
мировых исследований
мировых исследований
- Персонализированные виртуальные модели мозга (The Virtual Brain) – парадигма «цифровых близнецов» – как система поддержки принятия врачебных решений и прецизионное таргетирование (в частности, в хирургическом лечении эпилепсии)
- Прецизионная медицина при инсульте – персонализация прогноза с помощью методикискусственного интеллекта
- Персонализация терапии и прогнозирования течения рассеянного склероза на основании клинических, нейровизуализационных, нейрофизиологических и лабораторных биомаркеров
- Индивидуализация выбора вида эндоваскулярного вмешательства и отбора пациентов для механической тромбэктомии при ишемическом инсульте с помощью инструментов искусственного интеллекта
- Использование индуцированных плюрипотентных стволовых клеток (иПСК) в персонализации итаргетировании терапии нейродегенеративных, цереброваскулярных и травматических поражений центральнойнервной системы: выявление респондеров с помощью технологии «орган-на-чипе»; 3D-моделирование на основеиПСК; «симуляция» заболевания с иПСК
- Программно-ассистированные технологии нейровизуализации в персонализации лечения и диагностики неврологической патологии (в частности, эпилепсии, рассеянного склероза)
- Фундаментальные исследования в области нейрогеномики, нейропротеомики, нейрометаболики, нейрофармакологии при различных заболеваниях нервной системы
Основные достижения ПМ и примеры успешной реализации в мире
1
Цереброваскулярная патология
В аспекте цереброваскулярной патологии большие успехи получены в области персонализированной диагностики феномена аспиринорезистентности, который признается важным фактором неэффективности лечения и профилактики ишемических нарушений мозгового кровообращения (НМК).
- В начале нынешнего века был апробирован и запатентован способ индивидуального подбора антиагрегантного препарата на основании тест-системы с определением АДФ-индуцированной агрегации тромбоцитов.
- В дальнейшем, в том числе в работах Научного центра неврологии, были продемонстрированы новые способы индивидуализации назначения антиагрегантной терапии пациентам с сосудистыми заболеваниями нервной системы, основанные на молекулярно-генетическом, фармакокинетическом и гемостазиологическом подходах.
Развитие методик искусственного интеллекта и машинного обучения позволяют внедрять в клиническую практику модели для персонализированной оценки прогноза у пациентов, в частности с острыми цереброваскулярными заболеваниями.
- Так, модель ASTRAL, основанная на рутинных клинико-лабораторных показателях (возраст, тяжесть инсульта, время до поступления, уровень гликемии, уровень бодрствования, объем дефекта полей зрения), продемонстрировала высокую предиктивную значимость в отношении прогноза восстановления неврологического дефицита после ишемического инсульта.
- Использование наиболее современных модальностей нейровизуализации (в частности, функциональной МРТ) позволяет с высокой долей вероятности прогнозировать моторный дефицит после инсульта, а также развитие поведенческих нарушений.
Важным звеном персонализированной неврологии в аспекте ангионеврологии является предиктивность – возможность на основании определенного пула биомаркеров предсказать (оценить риск) развития инвалидизирующего НМК у (относительно) здорового человека.
Одним из таких факторов риска являются молекулярно-генетические альтерации в генах-кандидатах, ассоциированных с сосудистыми заболеваниями (атеросклероз, гипертония, кардиальная патология).
Одним из таких факторов риска являются молекулярно-генетические альтерации в генах-кандидатах, ассоциированных с сосудистыми заболеваниями (атеросклероз, гипертония, кардиальная патология).
- В совместной многолетней работе Научного центра неврологии с Центральным НИИ эпидемиологии была исследована мультипликативная модель риска развития ишемического инсульта на основании почти полусотни однонуклеотидных полиморфизмов.
- Одним из важных результатов этой работы стала не только демонстрация вклада генетики в общий риск инсульта, но и возможность с помощью данной методики проанализировать возможность развития конкретного подтипа ишемического инсульта (например, атеротромботического, кардиоэмболического и т.д.).
Нельзя не упомянуть появившиеся недавно возможности таргетной коррекции ряда сосудистых заболеваний, тесно связанных с цереброваскулярной патологией.
Одним из ведущих факторов риска последних является церебральный атеросклероз – хроническое заболевание, в патогенезе которого важную роль отводят воспалению и нарушениям липидного обмена.
Одним из ведущих факторов риска последних является церебральный атеросклероз – хроническое заболевание, в патогенезе которого важную роль отводят воспалению и нарушениям липидного обмена.
- В 2022 г. было опубликовано исследование малой интерферирующей РНК, таргетно снижающей уровни липопротеина(а) – биомаркера, который значимо ассоциирован с нестабильностью каротидной атеросклеротической бляшки и риском инсульта.
- В пилотном проекте по исследованию таких маркеров церебрального атеросклероза как микроРНК было показано, что снижение экспрессии miR-126 является потенциальным биомаркером выявления значимого каротидного стеноза с очень большой чувствительностью и специфичностью.
- антитромботической терапии;
- липидснижающей терапии;
- ангиореконструктивного вмешательства.
2
Эпилепсия
Одним из наиболее успешных в плане персонализации является диагностика и терапия такой важнейшей патологии, как эпилепсии.
Персонализация в лечении эпилепсии затронула не только медикаментозный, но и хирургический аспект.
- Использование биомаркеров и методик для индивидуализации прогноза и лечения пациентов с эпилепсией на сегодняшний день доступно практически на всех этапах лечебно-диагностического процесса.
- Успешно применяющиеся молекулярно-генетические методики выявления наследственных форм эпилепсии позволяют персонализировать выбор противосудорожной терапии на основании мутации в конкретном гене.
- Уже внедрен в клиническую практику метод терапевтического лекарственного мониторинга, который позволяет устанавливать индивидуальные терапевтические концентрации противоэпилептических препаратов (например, ламотриджина) в плазме крови, «визуализировать» их фармакокинетику и, при необходимости, персонализировать дозировку и (или) комбинацию лекарственных агентов.
Персонализация в лечении эпилепсии затронула не только медикаментозный, но и хирургический аспект.
- Возможности нейровизуализации позволяют с помощью методики диффузионно-тензорной МРТ в режиме трактографии на этапе до операции оценить анатомию волокон белого вещества, реализующих речевую функцию, затем персонализированно определить и наметить объем резекции и траекторию доступа, оптимальных для сохранения речевых трактов.
- Указанная технология позволяет значительно улучшить функциональные исходы операций при резистентных формах эпилепсии.
- В сложных случаях (дети, МР-негативные или мультифокальные варианты) гибридное исследование ПЭТ/МРТ позволяет локализовать эпилептогенную зону.
3
Демиелинизирующие заболевания
Ярким примером персонализированной диагностики может являться открытие благодаря биомаркерным исследованиям новых форм демиелинизирующих заболеваний, требующих совершенно иных терапевтических подходов.
Открытие и изучение новых биомаркеров – аквапорина 4 (AQP4), антител к миелин-олигодендроцитарному гликопротеину (MOG), а затем внедрение в клиническую практику методик их определения (непрямая иммунофлуоресценция с клеточной презентацией антигена), позволило выделить ранее неописанные формы тяжелых иммуннопосредованных демиелинизирующих заболеваний:
Открытие и изучение новых биомаркеров – аквапорина 4 (AQP4), антител к миелин-олигодендроцитарному гликопротеину (MOG), а затем внедрение в клиническую практику методик их определения (непрямая иммунофлуоресценция с клеточной презентацией антигена), позволило выделить ранее неописанные формы тяжелых иммуннопосредованных демиелинизирующих заболеваний:
- спектра оптикомиелита (NMO-IgG+),
- GFAP-астроцитопатия, MOG-ассоциированные энцефаломиелиты (MOG-IgG+), требующих совершенно других персонализированных терапевтических подходов.
4
Нейродегенеративные заболевания
Интенсификация исследований в области нейрогеномики привела к своеобразному «ренессансу» в сфере диагностики и лечения нейродегенеративных заболеваний. Так, благодаря новой методике массового параллельного секвенирования кратно увеличилось выявление генетических форм заболеваний, а инновационные подходы к генной терапии позволили осуществлять персонифицированное лечение ранее фатальных болезней.
Серьезные изменения коснулись и биомаркеров ранней (иногда даже доклинической) диагностики ряда нейродегенеративных заболеваний, причем важным является в том числе и очередность выявления маркерных альтераций. -
- Наиболее исследованной в этом плане остается болезнь Альцгеймера, где ранним биомаркером заболевания считается изменение содержания бета-амилоида-42 в ликворе, с последующим присоединением маркеров тау-патологии, изменением на МРТ и затем постепенным когнитивным снижением по данным нейропсихологического тестирований.
- Но персонализация доступна не только для диагностики болезни Альцгеймера, но и для выбора таргетной терапии, в том числе с использованием человеческих индуцированных плюрипотентных стволовых клеток, что потенциально ускорит выделение пациентов-респондеров.
Современные методики нейровизуализации, в частности функциональная МРТ покоя и воксель-ориентированная МР-морфометрия, активно исследуются в отношении дифференциальной диагностики болезни Паркинсона.
- Так, корреляции между особенностями функциональных пластических перестроек коры головного мозга и особенностями течения болезни Паркинсона и (или) реакцией на проводимую терапию позволяют использовать указанные высокоспециализированные нейровизуализационные последовательности для персонализации ранней диагностики и оценки эффекта от лечения.
- Последовательная интеграция подобных данных с мультимодальными исследованиями геномики, транскриптомики, метаболомики и протеомики в сочетании с доступными клиническими тестами может обеспечить всестороннее понимание механизмов развития болезни Паркинсона и медикаментозной терапии на системном уровне.
Наиболее известным успешным примером генной терапии в неврологии являются предложенные препараты для лечения спинальной мышечной атрофии на основе антисмысловых олигонуклеотидов и на основе аденоассоциированного вируса.
На сегодняшний день также предложена генная терапия для клинического применения при боковом амитрофическом склерозе, миодистрофии Дюшенна.
На сегодняшний день также предложена генная терапия для клинического применения при боковом амитрофическом склерозе, миодистрофии Дюшенна.
- При этом терапия миодистрофии Дюшенна максимально персонализирована и зависит от конкретной мутации в гене дистрофина. Предложена целая линейка препаратов для лечения таких пациентов от векторной доставки микродистрофина до различных вариантов «пропуска экзонов».
Персонализированная терапия предлагается не только для моногенных заболеваний, но и для отдельных генетических форм, рассматриваемых в рамках мультифакторных заболеваний.
- В этом ключе развивается таргетная, персонализированная терапия двух генетических форм болезни Паркинсона: GBA1- и LRRK2-ассоциированной.Для обеих форм предложены препараты, проходящие клинические исследования в три фазы.
- Для GBA1-паркинсонизма предлагается фармакологический шаперон – амброксол, который способствует правильному фолдингу белка глюкоцереброзидазы.
- Для LRRK2-паркинсонизма – ингибитор киназного домена, с которым связывают патологическое действие белка.
Выявление целевой группы пациентов для максимально персонализированной терапии – это один из аспектов успешного лечения нейродегенеративной патологии.
Еще одним аспектом является максимально раннее начало данной терапии – на продромальных, а в идеале – на преклинических стадиях.
Манифестация заболевания – это условно каскадный «срыв» этих компенсаторных механизмов, переход от разнообразных начальных процессов к относительно единообразным развернутым стадиям.
Еще одним аспектом является максимально раннее начало данной терапии – на продромальных, а в идеале – на преклинических стадиях.
- Развернутые стадии заболеваний как результат необратимых нейродегенеративных изменений не являются тем временным отрезком, когда можно предложить эффективную «восстановительную» терапию, по крайней мере, в самом ближайшем будущем.
- Тогда как преклинические и продромальные стадии рассматриваются в качестве потенциального терапевтического окна для проведения нейропротекторной и эффективной нозомодифицирующей терапии.
Манифестация заболевания – это условно каскадный «срыв» этих компенсаторных механизмов, переход от разнообразных начальных процессов к относительно единообразным развернутым стадиям.
- В связи с этим скрининговый поиск лиц на продромальных/преклинических стадиях заболевания, их подразделение на более однородные группы и проведение у них таргетной персонализированной протекторной терапии являются ключом к вторичной профилактике распространенных нейродегенеративных заболеваний.
- Для идентификации лиц на продромальных/преклинических стадиях разрабатываются алгоритмы для количественного расчета индивидуального риска развития того или иного мультифакторного заболевания.
Основные достижения российской науки и индустрии за последние годы
Разделение доступных отчетов по фундаментальным и прикладным исследованиям, которые касаются в той или иной степени персонализации в неврологии, в значительной степени условно, как и ориентировочное количество работ по соответствующим тематикам.
Разделение доступных отчетов по фундаментальным и прикладным исследованиям, которые касаются в той или иной степени персонализации в неврологии, в значительной степени условно, как и ориентировочное количество работ по соответствующим тематикам.
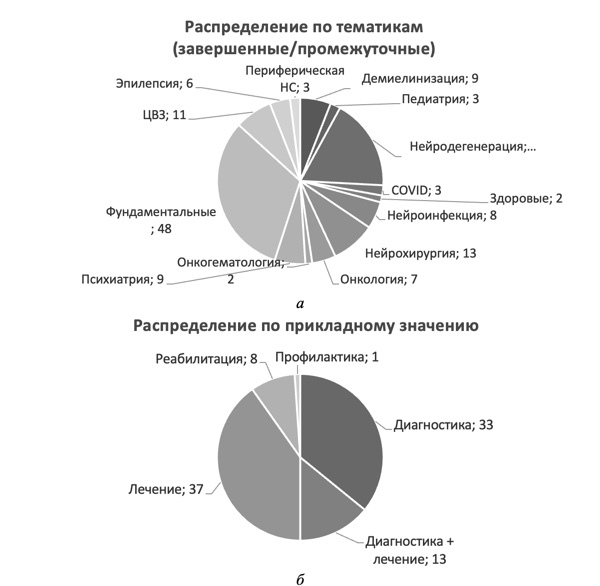
Рис. Распределение ключевых исследований по тематикам (а) и прикладному значению (б)