cостояние научных исследований
и перспективы практического применения
мировых исследований
- Разработка технологий и тест-систем для диагностики аутоиммунных и аутовоспалительных заболеваний путем полногеномного/полноэкзомного анализа с использованием методов высокопроизводительного секвенирования генома человека и эффективного биоинформатического анализа. Понимание дефектов иммунной системы, лежащих в основе моногенных форм аутоиммунных и аутовоспалительных заболеваний позволит сформировать алгоритмы таргетной фармакотерапии, основанной на выявленном генетическом дефекте и задействованных иммунных патомеханизмах.
- Разработка тест-систем различных заболеваний (в том числе инфекционных) на основе внеклеточных везикул.
- Поиск характерных мотивов Т-клеточных рецепторов, ассоциированных с развитием аутоиммунных и аутовоспалительных заболеваний в различных HLA контекстах с целью разработки технологий терапии с использованием метода секторальной супрессии субпопуляций Т-лимфоцитов.
- Клеточные технологии в ревматологии. Наиболее привлекательная сторона – возможность ее использования у фармакорезистентных пациентов.
- Трансплантация гемопоэтических стволовых клеток (ТГСК). Обеспечивает удаление аутореактивных Т-клеток памяти и регенерацию нормально функционирующей иммунной системы.
- Мезенхимальные стволовые клетки (МСК). Экспериментальные и клинические исследования показали, что при аутоиммунных заболеваниях МСК оказывают длительное противовоспалительное, иммуносупрессивное, антифибротическое действие, осуществляя регуляцию функции макрофагов, дендритных клеток, NK-клеток и В-лимфоцитов, снижают инфильтрацию CD8 T-лимфоцитами, Т-хелперами типов 1 (Th1) и 17 (Th17) и другими провоспалительными клетками за счет повышения иммуносупрессивных Т-регуляторных клеток (Treg).
- Treg-терапия. Тreg являются естественными иммуносупрессорными клетками, в норме ограничивающими величину и продолжительность иммунного ответа организма. Проводятся работы по получению антиген-специфических Treg-клеток in vitro путем трансформации антиген-специфических эффекторных Т-клеток (Teff) в клетки с супрессорной способностью. Стратегии перепрограммирования Teff-лимфоцитов в Treg-клетки: трансгенная сверхэкспрессия FOXP3 с использованием лентивирусов. Teff, трансдуцированныеFOXP3, выступают как Treg-подобный фенотип, выполняя иммуносупрессивные функции. Разработаны генетические инструменты CRISPR/Cas9 (Clustered Regulatory Interspaced Short Palindromic Repeats/Cas9) или TALEN (Transcription Activator-Like Effector Nucleases) для FOXP3-Teff посредством гомологического редактирования на основе репарации генов. Изучаются возможности получения человеческих антигенспецифических Treg-клеток из популяций Teff, обогащенных тетрамерами, путем введения трансгенного промотора FOXP3 с помощью TALEN и редактирования на основе аденоассоциированного вируса для лечения аутоиммунных заболеваний. Векторная доставка РНК-интерференции ретровирусами и лентивирусами одобрена FDA и EMA, однако лентивирусные векторы превосходят по профилю безопасности ретровирусные.
- Использование аутологичных толерогенных (тол) дендритных клеток (ДК). ДК в норме, в зависимости от степени зрелости, выступают в качестве стимулятора или ингибитора антигенспецифического иммунного ответа, а при их отсутствии или дефиците возрастает риск развития аутоиммунных реакций.
- Нанотехнологии. Система совместной доставки на основе нанотехнологий – точная транспортировка лекарства в клетки-мишени снижает системную токсичность и обеспечивает индивидуальный, неинвазивный подход к лечению.
- МикроРНК. Разрабатываемые терапевтические молекулы будут действовать не только посредством метаболического контроля в активной Т-клетке, но и посредством клеточной дифференцировки субпопуляций клеток, усиливая ее в сторону Т-клеточной линии (повышение Treg вместо клеток Th17). Динамическое изменение уровней некодирующих РНК на протяжении развития заболевания можно использовать в качестве биомаркера, помогающего в клинической диагностике и лечении. Целесообразным и стратегически важным для дальнейшего создания партнерства с фармацевтическими компаниями является разработка инновационных ЛС на основе экзосом, которые являются одним из самых передовых и набирающих обороты трендов в разработке биотехнологических ЛС. Экзосомы могут являться как носителями (карго) лекарственных средств, так и терапевтическими агентами, сочетая в себе необходимые терапевтические свойства, присущие живым клеткам, но не имея недостатков, имеющихся у ЛС.
- Технология интерференции РНК. Использование механизма интерференции РНК для блокировки экспрессии патогененетически важных биомолекул.
Формирование концепции о взаимосвязи между аутоиммунитетом и аутовоспалением – одно из крупнейших достижений биологии и медицины начала 21 в., которое может иметь фундаментальное значение для формирования научно обоснованных и эффективных подходов к профилактике, ранней диагностике и лечению широкого спектра распространенных потенциально смертельных болезней.
По современным представлениям в основе патогенеза иммуновоспалительных (аутоиммунных и аутовоспалительных) заболеваний (ИВЗ) лежит сложное сочетание генетически детерминированных и приобретенных дефектов иммунорегуляторных механизмов, ограничивающих патологическую активацию иммунной системы в ответ на потенциально патогенные факторы внешней среды (инфекции, нарушение микробиоты кишечника, курение, пародонтит и др.)
Аутоиммунные заболевания включают более 100 нозологических форм, представленных во всех разделах клинической медицины. В течение последнего десятилетия отмечена тенденцией к нарастанию частоты аутоиммунной патологии.
- По данным широкомасштабного эпидемиологического исследования (п = 22 009 375) общая частота 19 наиболее частых аутоиммунных заболеваний в популяции составила 10,2 % (13,1 % у женщин и 7,4 % у мужчин), у трети пациентов одномоментно выявляется более одного аутоиммунного заболевания.
- семейно-генетические исследования, выявившие высокий риск аутоиммунной патологии у кровных родственников пациентов,
- молекулярные-генетические исследования мутаций (полиморфизма) генов, участвующих в презентации антигенов и приобретенном иммунитете: аллели системы HLA (Human Leukocyte Antigens),локусыERAP1/2, PTPN22 (Protein Tyrosine Phosphatase Non-Receptor Type 22), JAK/STAT (Janus kinase/signal transducer and activator of transcription);
- изучение врожденного иммунитета и воспаления: сигнальные пути интерферона (ИФН), TLR (Toll-like receptor), Fc рецепторы и компоненты комплемента, Notch сигнализация, иммунометаболизм.
- Центральную роль в реализации генетической предрасположенности играет система HLA, участвующая в презентации аутоантигенов Т-клеткам.
- Полагают, что «чувствительность» к аутоиммунитету соответствует «мультигенной» модели, в рамках которой взаимодействие нескольких генетических компонентов оказывает глобальное влияние на презентацию аутоантигенов, активацию приобретенного и врожденного иммунитета, синтез и сигнализацию медиаторов воспаления.
- Одним из генов, не связанных с HLA, ассоциирующихся с развитием аутоиммунитета, является PTPN22, участвующий в клеточной сигнализации, опосредованной рецепторами Т- и В-клеток. Дополнительную роль могут играть эпигенетические нарушения и микроРНК, модифицирующие экспрессию генов, предрасполагающих к развитию аутоиммунитета.
При СКВ и некоторых других аутоиммунных заболеваниях имеет место пролонгированная гиперпродукция ИФН типа I, связанная с нарушением клиренса нуклеиновых кислот, высвобождающихся из подвергнутых апоптозу и NEToзу (Neutrophil Extracellular Traps) клеток, приводящая к образованию «интерфероногенных» иммунных клеток.
Для характеристики гиперпродукции ИФН типа I используют показатель, который получил название «ИФН типа I генный автограф» (Type I IFN gene signature – IFNGS), основанный на оценке экспрессии определенного спектра ИФН-зависимых генов, который потенциально позволяет выделить ИФН типа I зависимый эндотип аутоиммунных заболеваний.
Важнейшую роль в развитии аутоиммунных заболеваний играют В-клетки, значение которых рассмотрено в серии научных работ. Привлекает внимание роль так называемых ассоциированных с возрастом В-клеток (Age-associated B cells), накапливающиеся в кровяном русле и тканях у пациентов с аутоиммунными заболеваниями и регуляторных В-клеток (Врег), которые способны поддерживать периферическую толерантность и тем самым контролировать развитие аутоимунного воспаления.
Дефекты супрессорной активности Врег клеток обнаружено при СКВ, иммунной тромбоцитопенни, РА, АНЦА-ассоциированных системных васкулитах, пузырчатке. Характерным для аутоиммунной патологии нарушением В-клеточного иммунитета является активация экстрафолликулярного (ЭФ) пути В-клеточного иммунного ответа, ассоциирующегося с тяжелым течением СКВ. В контексте участия В-клеток в патогенезе аутоиммунной патологии привлекает внимание семейство В-клеточных цитокинов.
- К ним в первую очередь относится BAFF (B cell activating factor belonging to the TNF family), являющийся важным медиатором «цитокиновой» регуляции функции, пролиферации и дифференцировки В-клеток и мишенью для «антицитокиновой» терапии СКВ.
- В настоящее время широкий перечень моноклональных антител (мАТ), блокирующих функции различных провоспалительных цитокинов – фактор некроза опухоли α (ФНОα), интерлейкин (ИЛ)-1, ИЛ-5, ИЛ-6, ИЛ-12, ИЛ-17, ИЛ-23, зарегистрированы в мире для лечения ревматоидного артрита (РА), спондилоартритов (СпА), псориатического артрита (ПсА), гигантоклеточного артериита, эозинофильного гранулематоза с полиангиитом и других заболеваниях.
- Ингибиторы янус-киназ (JAK) одобрены для клинического применения при РА (тофацитиниб, барицитиниб, упадацитиниб) и псориатического артрита (тофацитиниб).
- ГИБП, ингибирующий костимуляцию Т-клеток (абатацепт), рекомендован при РА, в том числе обсуждается его эффективность при развитии интерстициального заболевания легких.
- Анти-В-клеточные ГИБП зарегистрированы при РА, системных васкулитах, ассоциированных с антинейтрофильными цитоплазматическими антителами (АНЦА-СВ), системной красной волчанке (СКВ), активно исследуются при других ИВРЗ.
Развитие подходов секвенирования дает информацию о структуре Т- и В-клеточных репертуаров. Однако высокое разнообразие иммунных рецепторов, а также сложность идентификации клональных консенсусов между пациентами делает анализ по поиску последовательностей Т- и В-клеточных рецепторов (ТКР и ВКР), связанных с заболеванием, крайне затруднительным.
- Недавно в двух независимых лабораториях была показана высокая степень ассоциированности TRBV9 с анкилозирующим спондилитом. Это дало предпосылку для получения мАТ к TRBV9 как потенциальной терапии данного заболевания.
- Проведены и проанализированы результаты доклинических и I фазы исследований, позволившие получить разрешение к проведению II фазы рандомизированного клинического исследования BCD-180-2/ELEFTA в марте 2022 г., где оценивается эффективность двух доз препарата BCD-180 в сравнении с показателями плацебо у пациентов с активным аксиальным спондилоартритом, наивных по применению ранее ГИБП.
Усовершенствованная формула молекулы (афукозилирование Fc фрагмета) опосредованно приводит к усилению анти-В-клеточного ответа и, как следствие, более выраженному истощению пула В-лимфоцитов.
- При этом дивозилимаб не влияет на врожденный иммунитет и общее количество Т-клеток.
- Результаты рандомизированных клинических исследований позволили зарегистрировать дивозилимаб для лечения рассеянного склероза, а в настоящее время проводятся исследования по эффективности и безопасности при системной склеродермии, оптиконевромиелите.
- В отличии от мАТ к рецепторам ИЛ-6 олокизумаб, специфически связывающийся с сайтом три молекулы ИЛ-6, ограничивает способность ИЛ-6 формировать гексамерный комплекс и тем самым блокирует активацию сигнального пути JAK-STAT.
- Результаты широкомасштабных, международных рандомизированных плацебо-контролируемых исследований (фаза III), полностью соответствующие международным стандартам оценки эффективности и безопасности ГИБП, свидетельствуют о высокой эффективности и безопасности олокизумаба, превосходящую мАТ к ФНО-α – адалимумаб, рассматривающуюся как «золотой стандарт» терапии РА.
- Предложен новый подход, основанный на расчете сходства между парами заболеваний в таксономии (сходства категорий, фенотипов, молекулярных профилей пар заболеваний в международной классификации болезней), создании ассоциативной сети, в которой узлы представляют заболевания, а значимость связей – соответствующие сходства их фенотипа или профиля молекулы с последующим построением интегрированной сети заболеваний, оценкой качества и валидации новой классификации.
- Указанный подход позволил в 2021 г. выделить три основных паттерна аутоиммунных заболеваний: воспалительный, лимфоидный, интерфероновый.
- Важная роль ИФН типа I в патогенезе ИВРЗ подтверждена в экспериментальных исследованиях на мышах со спонтанно развивающейся волчаночно-подобной патологией (NZB/NZWF1, MRL, у пациентов с наследственными моногенными интерферонопатиями (синдром Aicardi – Goutieres и др.) и, в последние годы, при ИВРЗ, которые рассматриваются как опосредованные ИФН типа I аутоиммунные заболевания.
- «перекрещивающийся» фенотип (поражение кожи, ЦНС, кожный васкулит, волчаночно-подобные проявления) при моногенных интерферонопатиях типа I и ИВРЗ, несмотря на различия в генотипе;
- обнаружение «ИФН типа I генного автографа» (IFNGS), коррелирующее с клиническими проявлениями и аутоиммунными нарушениями при ИВРЗ;
- данные об эффективности ингибиторов ИФНα при ИВРЗ;
- развитие широкого спектра «аутоиммунных» нарушений у пациентов, получающих терапию ИФНα по поводу вирусной инфекции или злокачественных новообразований.
Анифролумаб (MEDI546) – полностью человеческие мАТ (IgG1κ), которые, связываясь с IFNAR1, вызывают его интернализацию, тем самым блокируют гетеродимеризацию IFNAR2 и, как следствие, сигнализацию, опосредованную ИФНα и ИФНβ.
- Иммунологические эффекты анифролумаба включают ингибирование синтеза ИФН типа I, в меньшей степени других цитокинов, экспрессии CD80 и CD83, дифференцировки В-клеток в плазматические клетки.
- На основании результатов рандомизированных плацебо-контролируемых исследований, препарат был одобрен в Европейском союзе, США, Японии и Канаде в 2022 г., а в 2023 г. в РФ для лечения среднетяжелой и тяжелой СКВ, что имеет важное значение в персонализированной терапии пациентов.
- В настоящее время при АНЦА-СВ подтверждена высокая эффективность и безопасность разработанного персонифицированного алгоритма длительной поддерживающей анти-В-клеточной терапии ритуксимабом на основе регулярного мониторинга пациентов по показателям активности системного васкулита каждые три месяца и контролю репопуляции В-клеток, снижающего риск рецидива и частоту нежелательных явлений.
- У пациентов с недостаточной приверженностью к лечению и нарушениями протокола алгоритма доказано повышение частоты рецидивов в 3 раза, летальных исходов – в 3,8 раза и серьезных нежелательных явлений – в 4 раза.
- В настоящее время в России применение нинтеданиба одобрено как при идиопатическом легочном фиброзе и интерстициальном заболевании легких у пациентов с ССД, так и при других хронических фиброзирующих ИЗЛ с прогрессирующим фенотипом.
- Химерный антигенный рецептор состоит из высокоафинного антигенсвязывающего домена мАТ, реагирующего с антигеном-мишенью, и Т-клеточного домена, индуцирующего трансдукционный сигнал, для элимининации клеток-мишеней, не экспрессирующих молекулы ГКГ.
- В отличие от ритуксимаба, вызывающего деплецию CD20 В-клеток, в качестве мишени для CAR-T-клеточной терапии выбран CD19, который экспрессируется на В-клетках, находящихся на всех стадиях созревания (от про-В-клеток до ранних плазмабластов).
- Недавно представлены данные об успешном применении CD19 CAR-T-клеточной терапии у пациентки с тяжелым рефрактерным волчаночным нефритом.
Исследовательскими командами Института химической биологии и фундаментальной медицины СО РАН (Новосибирск), Научно-исследовательского института клинической и экспериментальной лимфологии – филиал ФИЦ Института цитологии и генетики СО РАН (Новосибирск) в настоящий момент разрабатывается комплексный подход к созданию новых способов терапии и диагностики анкилозирующего спондилита с использованием аптамеров, направленных на биомаркеры – ключевые участники его патогенеза: ФНО-α и интерлейкин-17А, а также ингибитор Wnt-сигнального пути белок Dickkopf-1.
- Введение аптамера вызывало значимое снижение активности артрита у модельных животных (на основании динамики счета пораженных суставов). Показана возможность использования тест-систем на основе аптамеров для специфичной детекции биомаркеров спондилоартритов.
- Особое внимание привлекает возможность использования аптамеров для разработки новых подходов к диагностике и терапии аутоиммунных заболеваний.
- Частая встречаемость этих заболеваний, их хронический характер и необходимость ранней диагностики требуют создания новых диагностических тест-систем, обеспечивающих долговременный мониторинг ряда биомаркеров.
- Так, например, впервые в начале 2022 г. были представлены данные клинических наблюдений пациентов с лихорадкой, рецидивирующим рефрактерным полиартритом, нейтрофильным дерматозом или кожным васкулитом, легочными инфильтратами, хондритом ушей и носа, венозной тромбоэмболией, макроцитарной анемией, системной воспалительной реакцией и обнаружением множественных вакуолей в цитоплазме миелоидных и эритроидных клеток предшественников в костном мозге.
- Секвенирование ДНК пациентов позволило впервые описать синдром VEXAS, доказав связь с мутацией сцепленного с Х хромосомой гена UBA1 [43].
- Так, выявление полиморфизма генов, кодирующих цитохром Р450 и витамин-К-эпоксидредуктазу, играет важную роль в определении дозы варфарина.
- Оценка полиморфизма гена SLCO1B1 позволяет прогнозировать развитие нежелательной реакции в виде миопатии при лечении статинами, установлена предсказательная ценность выявления полиморфизма отдельных генов для развития коронарной патологии.
- Широко обсуждаемая проблема схожести клинических фенотипов среди пациентов с моногенными периодическими лихорадками (CAPS, TRAPS, FMF-синдромы) поднимает вопрос о необходимости широкого внедрения определения генетических маркеров в ревматологическую практику.
- Согласно позиции экспертов EULAR, ранний и точный генетический диагноз позволяет направить на генетическое консультирование, провести соответствующий скрининг потенциальных осложнений, дать информацию о прогнозе и улучшить способность определять индивидуальные цели лечения и адаптировать решения о лечении.
Разные клинические проявления одного и того же заболевания могут быть обусловлены как неполной пенетрантностью гена при аутосомно-доминантном наследовании, так и с наличием мутаций одного гена с разной степенью повреждения белковой функции, а также соматическим мозаицизмом.
- В настоящее время подробно описана взаимосвязь генотипа и фенотипического варианта (включая ответ на лечение) у пациентов с TRAPS-синдромом.
- Показано, что пациенты с мутацией TNFRSF1A c.605T>A/V173D имели положительный клинический ответ на применение ингибитора ФНО-α этанерцепта в 80 % случаев, тогда как среди пациентов с наиболее распространенной мутацией p.Thr79Met наиболее предпочтительным вариантом лечения считается ингибитор ИЛ-1 канакинумаб.
- Показано, что пациенты, имеющие миссенс-варианты гена ADA2, как правило, отличались «воспалительным» фенотипом (с клиникой васкулита и др.) и хорошо отвечали на терапию ингибиторами ФНО-α, тогда как группа пациентов с мутациями, приводящими к полной потере активности белка (нонсенс, индел и др.), развивала фенотип с аплазией кроветворения и нуждавшихся в проведении ТГСК.
- Среди таких генов сильнее всего связаны с СД1 ген протеинтирозинфосфатазы нерецепторного типа 22 (PTPN22), ген рецептора типа α интерлейкина 2 (IL2RA) иCTLA42. Некоторые варианты перечисленных генов ассоциированы с нарушениями центральной и периферической толерантности к антигенам β-клеток, в частности, с появлением и пролиферацией аутореактивных Т-лимфоцитов, специфичных к β-клеткам.
- Связь СД1 с нарушениями иммунитета доказывается также наличием аутоантител к β-клеткам в сыворотке больных. Аутоантитела продуцируются плазматическими клетками – производными B-лимфоцитов, аутореактивных в отношении β-клеток. Они не играют существенной роли в деструкции β-клеток, но являются ее маркерами и потому имеют большое значение в прогнозировании, ранней и дифференциальной диагностике СД1.
- Существующий общепринятый подход к лечению СД1 включает четыре основных компонента: инсулинотерапию, самостоятельный контроль уровней глюкозы в крови, диетотерапию и обучение принципам управления заболеванием, и по сути является симптоматическим лечением, нацеленным на компенсацию «итогов» патогенеза СД1 и возмещение абсолютного дефицита инсулина
- Современные достижения в понимании патогенеза заболевания позволили фокусироваться на идеях иммунотерапии СД1.
Благодаря быстрому прогрессу молекулярной иммунологии и биотехнологии становится возможным говорить уже о препаратах, потенциально пригодных для иммунопрофилактики и иммунотерапии аутоиммунного варианта СД1.
Это направление медицины особенно активно разрабатывается в стране благодаря сотрудничеству НИИР им. В.А. Насоновой и МНИИ психиатрии – филиала «Национальный медицинский исследовательский центр психиатрии и наркологии им. В.П. Сербского» МЗ РФ.
- По современным представлениям, ПР, прежде всего депрессия, являются одним из наиболее частых коморбидных ИВРЗ заболеваний и обнаруживается у 40–96 % пациентов, что превышает ее частоту в общей популяции в 3–8 раз.
- Доказано, что РТДС имеют общие с ИВРЗ провоцирующие стрессовые факторы и аутоиммунные провоспалительные механизмы патогенеза, в первую очередь – нарушения в регуляции стрессового и иммунного ответа, дисбаланс в работе гипоталамо-гипофизарно-надпочечниковой системы, сопровождающиеся гиперпродукцией провоспалительных цитокинов (ФНО-α, ИЛ-1β, ИЛ-6, ИЛ-12, ИЛ-17, ИЛ-18, ИНФ-γ), снижением противовоспалительных цитокинов (ИЛ-10, TФР-β), приводящими к снижению биодоступности нейротрансмиттеров, выработки нейротрофических факторов, что снижает нейрогенез, приводит к прогрессированию нейродегенерации и сопровождается развитием симптомов депрессии, тревоги, КН, усугубляет выраженность хронической боли, усталости.
- Нередко депрессия возникает задолго до дебюта ИВЗ и является фактором риска их развития.
- Остается открытым вопрос о возможном положительном влиянии ГИБП, в первую очередь ингибиторов ИЛ-6 и ИЛ-17А на симптомы депрессии. В настоящее время получены предварительные обнадеживающие результаты, свидетельствующие об эффективности российского ингибитора ИЛ-6 олокизумаба в отношении уменьшения симптомов депрессии у больных РА.
Вместе с тем фундаментальные и клинические проблемы аутоиммунитета и аутовоспаления далеки от окончательного решения, что обусловлено мультифакториальной природой заболеваний со сложными, во многом не расшифрованными иммунопатологическими механизмами и недостаточно изученными предикторами эффективности и резистентности к терапии, трудностями ранней диагностики, тяжелым течением, риском инфекционных и других осложнений, обусловленных фармакотерапией, в том числе с использованием инновационных препаратов.
На основании Приказа Министерства здравоохранения РФ от 1 марта 2022 г. N 124 «Об организации работы по созданию научно-образовательных комплексов полного цикла» для развития персонифицированной медицины в области аутоиммунных и аутовоспалительных заболеваний должна быть сформулирована новая система взаимоотношений фундаментальной науки, клинической медицины и государства, когда фундаментальная наука будет признана приоритетом, а ее достижения будут иметь возможность исследоваться и внедряться в клиническую практику.
- Объединить усилия ведущих научно-медицинских центров, университетов и институтов в изучении механизмов патогенеза аутоиммунных и аутовоспалительных болезней с применением методов молекулярно-генетического, эпигенетического и биоинформационного анализа с привлечением финансовых ресурсов (грантов, государственных программ, фармкомпаний).
- Разработка технологий и тест-системы для диагностики аутоиммунных и аутовоспалительных заболеваний путем полногеномного/полноэкзомного анализа с использованием методов высокопроизводительного секвенирования генома человека и эффективного биоинформатического анализа.
- Разработка, клиническая валидация и внедрение алгоритмов персонализации применения жизненно важных лекарственных препаратов (приорететно оригинальных отечественных) на основе фармакогенетических, фармакокинетических исследований, а также новых биомаркеров (микроРНК, транскриптомных протемоных, микробиомных и т.д.) у пациентов с аутовоспалительными и аутоиммунными заболеваниями.
- Разработка новых технологических платформ клеточной терапии с использованием аутологичных клеточных препаратов, технологий создания тканеинженерных конструкций, биодеградируемых конструкций и других для лечения аутоиммунной/аутовоспалительной патологии.
- Одним из ключевых инструментов персонифицированной медицины является выявление сывороточных и тканевых лабораторных биомаркеров, предоставляющих информацию для ранней диагностики аутоиммунного и аутовоспалительного патологического процесса, выявления риска быстрого прогрессирования заболевания или его неблагоприятного исхода, прогнозирования ответа пациента на различные таргетную терапию. Наиболее перспективным является интегральный подход к исследованию различных биомаркеров, включая генетические факторы (с использованием метода секвенирования генома, профилей экспрессии РНК и некодирующих РНК), белки воспаления и метаболизма (масс-спектрометрия, мультиплексный анализ), метаболиты (масс-спектрометрия, ядерный магнитный резонанс), содержание антител к моноклональным антителам и лекарственных препаратов (автоматизированные платформы иммуноанализа).
- Создание новых и совершенствование существующих образовательных программ по генетическим технологиям, подготовка кадров, стажировка сотрудников, привлечение и закрепление ведущих ученых и перспективных молодых специалистов в области персонифицированной медицины. Создание экосистемы образования и просвещения в области медицинской иммунологии, в том числе разработка современных образовательных программ дополнительного профессионального образования по фундаментальной, клинической и экспериментальной иммунологии.
Xiao F., Rui K., Shi X. et al. Epigenetic regulation of B cells and its role in autoimmune pathogenesis // Cell Mol Immunol. 2022;19(11):1215-1234. DOI: 10.1038/s41423-022-00933-7
Насонов Е.Л., Попкова Т.В., Лила А.М. Белимумаб в лечении системной красной волчанки: 20 лет фундаментальных исследований, 10 лет клинической практики // Научно-практическая ревматология. 2021;59(4):367-383. DOI: 10.47360/1995-4484-2021-367-383
Насонов Е.Л., Авдеева А.С. Иммуновоспалительные ревматические заболевания, связанные с интерфероном типа I: новые данные // Научно-практическая ревматология 2019;57(4):452-461
Насонов Е.Л., Решетняк Т.М., Соловьев С.К., Попкова Т.В. Системная красная волчанка и антифосфолиидный синдром: вчера, сегодня, завтра // Терапевт архив. 2023;95 (5).
Насонов Е.Л., Бекетова Т.В., Ананьева Л.П. и др. Перспективы анти-В-клеточной терапии при иммуновоспалительных ревматических заболеваниях // Научно-практическая ревматология. 2019;57:1-40. DOI: 10.14412/1995-4484-2019-3-40
Avdeeva A., Rubtsov Y., Dyikanov D. et al. Regulatory T cells in patients with early untreated rheumatoid arthritis: Phenotypic changes in the course of methotrexate treatment // Biochimie. 2020;174:9-17. DOI: 10.1016/j.biochi.2020.03.014.
Jenks S.A., Cashman K.S., Woodruff M.C. et al. Extrafollicular responses in humans and SLE // Immunol Rev. 2019;288(1):136-148. DOI: 10.1111/imr.12741
Насонов Е.Л. Фармакотерапия ревматоидного артрита: новая стратегия, новые мишени. Научно-практическая ревматология. 2017;55(4):409-419. DOI: 10.14412/1995-4484-2017-409-419
Насонов Е.Л., Решетняк Т.М., Соловьев С.К., Попкова Т.В. Системная красная волчанка и антифосфолиидный синдром: вчера, сегодня, завтра // Терапевт архив. 2023;95 (5).
Nasonov E., Fatenejad S., Feist E. et al. Olokizumab, a monoclonal antibody against interleukin 6, in combination with methotrexate in patients with rheumatoid arthritis inadequately controlled by methotrexate: efficacy and safety results of a randomised controlled phase III study // Ann Rheum Dis. 2022 Apr;81(4):469-479. DOI: 10.1136/annrheumdis-2021-219876
Smolen J.S., Feist E., Fatenejad S. et al. CREDO2 Group. Olokizumab versus Placebo or Adalimumab in Rheumatoid Arthritis // N Engl J Med. 2022 ;387(8):715-726. DOI: 10.1056/NEJMoa2201302
Mackensen A., Müller F., Mougiakakos D. et al. Anti-CD19 CAR T cell therapy for refractory systemic lupus erythematosus // Nat Med. 2022;28(10):2124-2132. DOI: 10.1038/s41591-022-02017-5.
Schnappauf O., Aksentijevich I. Current and future advances in genetic testing in systemic autoinflammatory diseases // Rheumatology (Oxford). 2019;58(Suppl 6):vi44-vi55. DOI:10.1093/rheumatology/kez294
Stojanov S., Dejaco C., Lohse P. et al. Clinical and functional characterisation of a novel TNFRSF1A c.605T>A/V173D cleavage site mutation associated with tumour necrosis factor receptor-associated periodic fever syndrome (TRAPS), cardiovascular complications and excellent response to etanercept treatment // Ann Rheum Dis 2008;67(9):1292-1298. DOI:10.1136/ard.2007.079376
Laigle L., Chadli L., Moingeon P. Biomarker-driven development of new therapies for autoimmune diseases: current status and future promises // Expert Rev Clin Immunol. 2023;19(3):305-314. DOI: 10.1080/1744666X.2023.2172404
Felten R., Mertz P., Sebbag E. et al. Novel therapeutic strategies for autoimmune and inflammatory rheumatic diseases // Drug Discov Today. 2023;28(7):103612. DOI: 10.1016/j.drudis.2023.103612

мировых исследований
- Поиск новых ингибиторов бактериального роста в настоящий момент ведется в основном государственными организациями, так как для фармацевтических компаний эта задача является нерентабельной.
- Механизмы устойчивости микроорганизмов к антибактериальным препаратам разнообразны и представляют собой защитную систему микробов от собственных и чужеродных антимикробных соединений.
- В настоящее время появились мульти- и пан-резистентные патогенные штаммы, устойчивые к нескольким классам и даже ко всем классам антибиотиков одновременно.
- Устойчивость возбудителей к антибиотикам усложняет лечение тяжелых инфекционных заболеваний и приводит к росту смертности. Ежегодно от инфекций, вызванных устойчивыми к антибиотикам бактерий, умирает около 700 тыс. человек. По экспертным оценкам к 2050 г. количество ежегодных смертей может возрасти до 10 млн. 31 августа 2023 г. эта проблема была рассмотрена на заседании Президиума Совета при Президенте РФ по науке и образованию в рамках рассмотрения важнейшего инновационного проекта государственного значения Российской научно-технической платформы оперативного реагирования на инфекционные заболевания.
- Одним из наиболее узких мест в развитии области остается понимание механизмов действия антибиотических средств. В качестве одной из ключевых мишеней антибиотиков остается бактериальная рибосома.
- В настоящее время в мире имеется несколько групп, подробно описавших различные ингибиторы трансляции, – это группы под руководством А.С. Манькина (США), Д.Н. Вилсона (Германия), П.В. Сергиева (РФ).
- В последнее время вновь интерес в мире стали привлекать пептидные антибиотики. В РФ этой проблемой занимаются в ГНЦ ИБХ профессор Овчинникова Т.В. Создание пептидных антибиотиков на основе молекулярных факторов системы врожденного иммунитета – защитных антимикробных пептидов (АМП) эукариот и бактериоцинов (АМП бактерий) – вызывает значительный интерес у научного сообщества, что подтверждается большим количеством публикаций в высокорейтинговых научных журналах, а также существенным ростом числа клинических испытаний противоинфекционных препаратов этого класса.
- В ГНЦ ИБХ проведен комплексный биоинформатический анализ природного биоразнообразия защитных АМП животных. Изучение природных универсальных путей биосинтеза защитных пептидов (в первую очередь BRICHOS- и CLD-ассоциированных) позволило выявить новые семейства АМП с уникальной структурой, мишенями которых являются не только мембраны бактерий, но и 70S рибосома, а также целый ряд эссенциальных биомолекул, таких как белки Lpt-комплекса.
- Ряд запатентованных в ГНЦ ИБХ природных АМП и их модифицированных аналогов показали высокую эффективность в качестве пептидных антибиотиков системного применения на летальных животных моделях бактериальной септицемии. Сравнительно невысокая токсичность относительно конвенциальных антибиотиков последней линии (например, колистина), а также незначительный риск развития бактериальной резистентности позволяют рассматривать их в качестве перспективных соединений для проведения доклинических и клинических испытаний в качестве пептидных антибиотиков.
В ИЭМ на протяжении более 30 лет проводится исследование антимикробных пептидов врожденного иммунитета. Работы проводились в том числе при сотрудничестве с ГНЦ ИБХ РАН. В настоящее время в рамках развития НЦМУ «Центр персонализированной медицины» на основе природных АМП в ИЭМ разрабатываются новые пептидные препараты для применения в терапии раневых инфекций, вызываемых антибиотикоустойчивыми бактериями группы ESCAPE.
- Запатентован пептидный препарат, обладающий антибактериальной активностью в отношении микроорганизмов с множественной лекарственной устойчивостью; создаются комбинированные препараты широкого спектра действия, включающие пептиды, антибиотики, антисептики проявляющие активность против бактериальных биопленок.
В связи с развитием проблем, связанных с внутрибольничными инфекциями и проблемами резистентности, на повестку дня ставится вопрос об антимикотической терапии.
- В настоящее время возможности антимикотической терапии ограничены наличием всего нескольких групп противогрибковых препаратов: азолы, эхинокандины, полиеновые макроциклы. Данные препараты имеют высокую цену, применяются в больших дозировках и являются токсичными средствами, вызывающими нарушения в системе ЖКТ, почек и печени пациентов. Из-за ограниченного числа мишеней и сходного механизма действия постепенно растет количество полирезистентных штаммов микопатогенов, устойчивых к большинству доступных препаратов.
- В связи с этим актуальной задачей является разработка терапевтических моноклональных антител, направленных против антигенов клеточной стенки основных грибковых патогенов. Данные иммунопрепараты могут применяться в синергии с существующими антигрибковыми препаратами, увеличивая эффективность лечения инвазивных микозов и снижая дозы лекарств, а, следовательно, и токсическую нагрузку на организм пациента.
- Несмотря на то, что иммунопрепаратов данного типа, прошедших полные клинические испытания и регистрацию, до сих пор в мире нет, фундаментальные исследования в данном направлении активно ведутся. Благодаря этому установлены структуры полисахаридов клеточной стенки грибов, в особенности бета-D-глюкана, бета-D-маннана и других, которые могут экспонировать эпитопы потенциальных терапевтических моноклональных антител, обладающих защитным действием.
- Именно эти полисахариды и рассматриваются в качестве мишеней для разработки терапевтических моноклональных антител. Данные подходы развиваются в РФ в Институте органической химии им. Н.Д. Зелинского РАН и в ряде других лабораторий мира.
Значительный интерес вызывает исследование ферментов фагов. В последнее десятилетие, в рамках борьбы с резистентностью к антибиотикам, в развитых странах ускоренно развивались технологии лечения заболеваний, вызванных лекарственно устойчивыми бактериями с помощью бактериофагов.
- Достигнуты значительные успехи, показано, что лечение может быть успешным только в варианте персонализированного подбора фаговых препаратов.
- Начаты работы по получению терапевтических бактериофагов методами синтетической биологии, разрабатываются технологии производства бактериофагов в бесклеточной системе, позволяющие избежать работы с патогенными бактериями.
- Развернуты работы по экспериментальному лечению бактериофагами больных, не отвечающих на терапию антибиотиками в специальных центрах в США (главный центр – Center for Innovative Phage Applications and Therapeutics, University of California, San Diego, La Jolla, California, USA), Китая, ведущих европейских стран и в Австралии. Фаготерапия все шире применяется в давно функционирующий центрах в Грузии и Польше, а в России – в НПО Микроген.
В то же время одним из ключевых факторов успешного лечения инфекционных заболеваний является своевременная и точная диагностика.
- Персонализация в диагностике заключается в том, что применяемые тест-системы должны не только определять сам патоген, но и выявлять его возможные детерминанты патогенности и предсказывать ход развития инфекционного процесса у конкретного пациента на основе анализа биомаркеров, характеризующих иммунный ответ, генетическую и приобретенную восприимчивости к инфекционному заболеванию, взаимодействие хозяин-патоген.
- Следует отметить необходимость комплексной оценки совокупности присутствующих в организме хозяина генов резистентности (резистома), который модулирует течение как инфекционных, так и неинфекционных заболеваний человека.
Эффективность вакцинации достигается за счет максимального охвата населения при использовании ограниченного числа вакцин. Однако ответ на вакцинацию является индивидуальным и в зависимости от инфекции остаются серонегативными до 10 % вакцинированных. Для части вакцин это явление исследовано и известно, что у подавляющей части таких людей очень хороший Т-клеточный иммунный ответ.
В связи с этим основными трендами современной вакцинологии являются:
- проведение иммунологических скринингов эффективности вакцинации;
- выявление групп, не отвечающих на вакцинацию;
- разработка разных типов вакцин для отдельных групп населения (например, детей, лиц пожилого возраста, беременных, пациентов с хроническими заболеваниями) с перспективой персонализированной вакцинации для каждого конкретного пациента.
Наряду с совершенствованием направлений по созданию аттенуированных вакцин, пробиотических мукозальных, синтетических и аденовирусных вакцин представляется целесообразным создать платформу по получению мРНК-вакцин.
- Подобная платформа может быть использована для разработки персонифицированной доставки противораковых препаратов на основе мРНК. Для этой цели разрабатывается липосомальная форма доставки, совершенствуются подходы к получению фрагментов нетранслируемых областей РНК для оптимизации экспрессии антигенов.
- Системы, позволяющие производить поиск веществ, которые подавляют рост определенного вида бактерий, например, M. Tuberculosis. Данный подход применяется группой Д.С. Сачетини (США).
- Системы, позволяющие производить поиск веществ определенной структуры, например, макролидов. Данная система применяется группой А. C. Манькина (США).
- Системы, позволяющие проводить поиск веществ, действующих по определенным механизмам действия, например, индукторы SOS-ответа и ингибиторы трансляции. Данная система применяется группой П.В. Сергиева (РФ). Механизм-ориентированный подход является одним из самых перспективных, так как в данном случае могут быть обнаружены молекулы любого строения и с первого этапа есть понимание по какому пути действует активное соединение на клетку.
- In silico дизайн терапевтических средств с учетом молекулярного полиморфизма белковых мишеней, включая репозиционирование лекарств.
- Определение молекулярных механизмов резистентности новых штаммов.
- Анализ геномов бактерий и вирусов для выявления вирус-специфических ферментов как мишеней для терапии.
- Оценка вклада резистома микробиома человека в развитие инфекционных и неинфекционных патологий.
- Анализ геномов пациента для прогнозирования степени тяжести протекания заболевания.
2. Panteleev P.V. et al. Combined antibacterial effects of goat cathelicidins with different mechanisms of action. Front // Microbiol. 2018, 9, 2983. DOI: 10.3389/fmicb.2018.02983
3. Ovchinnikova T.V. Structure, Function, and Therapeutic Potential of Marine Bioactive Peptides // Marine Drugs. 2019, 17, 505. DOI: 10.3390/md17090505
4. Panteleev P.V. et al. Structure Elucidation and Functional Studies of a Novel β-hairpin Antimicrobial Peptide from the Marine Polychaeta Capitella teleta // Marine Drugs, 2020, 18, 620. DOI: 10.3390/md18120620
5. Bolosov I.A. et al. Dodecapeptide Cathelicidins of Cetartiodactyla: Structure, Mechanism of Antimicrobial Action, and Synergistic Interaction With Other Cathelicidins // Front. Microbiol. 2021. 12:725526. DOI: 10.3389/fmicb.2021.725526
6. Ovchinnikova T.V. Marine Peptides: Structure, Bioactivities, and a New Hope for Therapeutic Application // Mar. Drugs. 2021, 19, 407. DOI: 10.3390/md19080407
7. Safronova V.N. et al. Mechanism of Action and Therapeutic Potential of the Beta-Hairpin Antimicrobial Peptide Capitellacin from the Marine Polychaeta Capitella teleta // Mar. Drugs. 2022, 20, 167. DOI: 10.3390/md20030167
8. Panteleev P.V. et al. A Novel Proline-Rich Cathelicidin from the Alpaca Vicugna pacos with Potency to Combat Antibiotic-Resistant Bacteria: Mechanism of Action and the Functional Role of the C-Terminal Region // Membranes. 2022, 12, 515. DOI: 10.3390/membranes12050515
9. Safronova V.N. et al. Novel β-Hairpin Peptide from Marine Polychaeta with a High Efficacy against Gram-Negative Pathogens // Marine Drugs. 2022, 20, 517. DOI: 10.3390/md20080517
10. Guryanova S.V., Ovchinnikova T.V. Innate Immunity Mechanisms in Marine Multicellular Organisms // Marine Drugs. 2022, 20, 549. DOI:10.3390/md20090549
11. Panina I.S. et al. Specific binding of the α-component of the lantibiotic lichenicidin to the peptidoglycan precursor lipid II predetermines its antimicrobial activity // Int. J. Mol. Sci. 2023, 24, 1332, DOI: 10.3390/ijms24021332
12. Panteleev P.V. et al. Genomic Insights into Bacterial Resistance to Proline-Rich Antimicrobial Peptide Bac7 // Membranes. 2023, 13, 438. DOI: 10.3390/membranes13040438
13. Bolosov I.A. et al. Design of protegrin-1 analogs with improved antibacterial selectivity // Pharmaceutics. 2023, 15, 2047. DOI: 10.3390/pharmaceutics15082047
14. Bogdanov I.V. et al. Epithelial-Immune Cell Crosstalk Determines the Activation of Immune Cells In Vitro by the Human Cathelicidin LL-37 at Low Physiological Concentrations // Biomolecules. 2023, 13, 1316. DOI: 10.3390/biom13091316
15. Guryanova S.V. et al. Marine Invertebrate Antimicrobial Peptides and Their Potential as Novel Peptide Antibiotics // Mar. Drugs. 2023, 21, 503. DOI: 10.3390/md21100503
Terekhov S.S. et al. Liquid drop of DNA libraries reveals total genome information // Proc Natl Acad Sci USA. 2020 Nov 3;117(44):27300-27306. DOI: 10.1073/pnas.2017138117
Terekhov S.S. et al. A kinase bioscavenger provides antibiotic resistance by extremely tight substrate binding // Sci Adv. 2020 Jun 24;6(26):eaaz9861. DOI: 10.1126/sciadv.aaz9861
2. Zharkova M.S., Golubeva O.Y., Orlov D.S. et al. Silver nanoparticles functionalized with antimicrobial polypeptides – benefits and possible pitfalls of a novel anti-infective tool // Front. Microbiol. 2021. 12:750556. DOI: 10.3389/fmicb.2021.750556
3. Zharkova M.S., Orlov D.S., Golubeva O.Yu. et al. Application of antimicrobial peptides of the innate immune system in combination with conventional antibiotics – a novel way to combat antibiotic resistance? // Front. Cell. Infect. Microbiol. 2019. DOI: 10.3389/fcimb.2019.00128
4. Kopeikin P.M., Zharkova M.S., Kolobov A.A. et al. Caprine Bactenecins as Promising Tools for Developing New Antimicrobial and Antitumor Drugs // Frontiers in Cellular and Infection Microbiology. 2020. Vol. 10. 52905. DOI: 10.3389/fcimb.2020.552905
5. Климов Н.А., Шамова О.В. Бактериальные вагинозы. Санкт-Петербург: СпецЛит, 2023. 287 с.
6. Патент на изобретение № 2771493 C1. Пептид, обладающий антибактериальной активностью в отношении микроорганизмов с множественной лекарственной устойчивостью / Шамова О.В., Жаркова М.С., Орлов Д.С., Комлев А.С., Владимирова Е.В., Овчинникова Т.В., Пантелеев П.В., Баландин С.В., Климов Н.А. 05.05.2022. Заявка № 2021110763 от 15.04.2021.
2. Cywes-Bentley C. et al. Antibody to a Conserved Antigenic Target is Protective Against Diverse Prokaryotic and Eukaryotic Pathogens // Proc. Natl. Acad. Sci. USA. 2013, 110, E2209-E2218.
3. Schubert M. et al. Monoclonal Antibody AP3 Binds Galactomannan Antigens Displayed by the Pathogens Aspergillus flavus, A. fumigatus, and A. parasiticus // Front. Cell. Infect. Microbiol. 2019. 9. 234.
2. Matveev A.L. et al. Novel mouse monoclonal antibodies specifically recognizing β-(1→3)-D-glucan antigen // PLoS ONE. 2019; 14; e0215535.
3. Kumaresan P. R. et al. Bioengineering T cells to target carbohydrate to treat opportunistic fungal infection // Proc. Natl. Acad. Sci. USA. 2014, 111, 10660–10665.
4. Lian X. et al. A Novel Monoclonal Antibody 1D2 That Broadly Inhibits Clinically Important Aspergillus Species // J. Fungi. 2022, 8, 960.
5. Trevijano-Contador N., Pirofski L.-A. Antibody Immunity and Natural Resistance to Cryptococcosis // Current Tropical Medicine Reports. 2019. 6:50–54.
6. Tomas Di Mambro et al., A new humanized antibody is effective against pathogenic fungi in vitro // Scientific Reports. 2021, 11; 19500.
7. Raglow Z. et al. Targeting glycans for CAR therapy: The advent of sweet CARs // Molecular Therapy. 2022. 30; 2881-2890.
- Проблема поиска новых антибиотиков остро стоит перед современным научным сообществом. Природные источники до сих пор являются ключевыми ресурсами поиска новых антибиотиков.
- При помощи репортерной системы pDualrep2 в лаборатории нуклеопротеидов химического факультета МГУ, а также в научном центре Сириус ведется поиск продуцентов новых антибиотиков. В результате этого поиска были обнаружены такие ингибиторы бактериальной трансляции как Гетиамицины E и F, Бейлунмицин, Альбомицин и Боррелидин, а в каких-то случаях и охарактеризованы, например, тетраценомицин Х и родственные ему соединения.
- При помощи данного подхода был обнаружен ингибитор ДНК-гиразы бактерий нибомицин и описан молекулярный механизм его действия.
- Одним из подходов, повышающих вероятность нахождения нового антибактериального химического соединения, является поиск продуцентов из необычных мест обитания , а также привлечение к работе с продуцентами «гражданских ученых» .
- Поиск соединений среди химических библиотек так же приносит свои плоды– для анализа данных такого поиска используются как классические подходы, так и современные, использующие машинное обучение.
- Помимо этого для создания новых антибиотических препаратов используется изучение механизма действия и сайта связывания открытых антибиотиков, что является важным этапом в химической модификации антибиотиков.
- Бета-лактамные антибиотики (пенициллины, цефалоспорины, карбапенемы, монобактамы) являются наиболее широко применяемыми антибактериальными средствами (их доля составляет более 60 %).
- Основным механизмом устойчивости к ним является продукция бактериальных ферментов бета-лактамаз, гидролизующих антибиотик, что приводит к клинической неэффективности бета-лактамов.
- Основной стратегией преодоления резистентности бактерий является изучение свойств данных суперсемейств и поиск эффективных ингибиторов ферментов.
- Другими механизмами резистентности бактерий к антибиотикам являются активация систем эффлюкса и изменения поринов клеточной мембраны. В реализации этих механизмов также участвуют бактериальные ферменты.
- Гены большинства ферментов, ответственных за развитие антибиотикорезистентности, локализованы на мобильных генетических элементах (плазмидах), что обуславливает широкое распространение резистентности к различным антибиотикам, которое называют «тихой пандемией».
- Современные антибиотики представляют собой сложные органические молекулы, которые могут вызывать много различных побочных эффектов.
В связи с этим необходимо развивать индивидуальную (персонализированную) химиотерапию для больных онкологическими заболеваниями, аллергией, иммунодефицитами и ВИЧ-инфицированных. Особой проблемой является трансплантация органов, хирургические операции, детские болезни и беременность женщин.
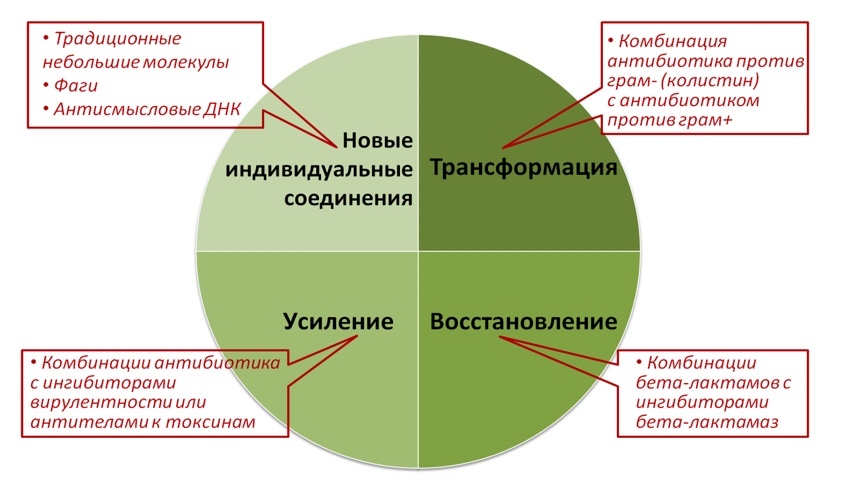
Нетрадиционные подходы («Трансформация», «Усиление» и «Восстановление») основаны на использовании комбинаций препаратов. К «Трансформации» относят использование препаратов, преобразующих или расширяющих действие существующих антибактериальных препаратов, ставших нечувствительными к антибиотикам (например, добавление к аналогам полимиксина В, действующих на грамотрицательные бактерии, препаратов для грамположительных бактерий). На настоящий момент такие комбинации, прошедшие государственную регистрацию, отсутствуют в мире и РФ. Принцип «Увеличения» предполагает использование препаратов, направленных на усиление или улучшение действия активного и эффективного антибиотика (например, препаратов, действующих на снижение бактериальной вирулентности или нейтрализацию бактериальных токсинов). В качестве примера рассматриваются: моноклональное антитело (раксибакумаб) к токсину Bacillus anthracis; поликлональная лошадиная антисыворотка к токсинам Corynebacterium diphtheriae; антисыворотка к токсинам, продуцируемым Clostridium botulinum; поликлональная человеческая антисыворотка к токсинам, продуцируемым Clostridium tetani. Сходным, но не идентичным механизмом характеризуется моноклональное антитело к токсину C. Difficile (безлотоксумаб), его основной эффект заключается в уменьшении рецидивов после стандартной антибиотикотерапии. Принцип «Восстановления» относится к использованию соединений, восстанавливающих активность существующего антибиотика, утратившего активность из-за развития резистентности (например, комбинации бета-лактамов с ингибиторами бета-лактамаз).
- Данные работы включают экспрессию ферментов, ответственных за резистентность, изучение механизмов их взаимодействия с антибиотиками, рентгено-структурный анализ комплексов бета-лактамаз с ингибиторами, изучение влияния мутаций бета-лактамаз на активность и стабильность ферментов.
- Одновременно проводится скрининг ингибиторов сериновых и метало-бета-лактамаз, поиск аллостерических центров регуляции их активности.
- В работе широко используются различные методы компьютерного моделирования структуры бактериальных ферментов и их комплексов с ингибиторами. Работа проводится в сотрудничестве с институтами РАН и медико-биологическими центрами.
Поиск проводится по двум направлениям – скрининг препаратов с новой структурой и репозиционирование уже известных лекарственных препаратов. Отобраны несколько ингибиторов-кандидатов, один из них находится на стадии доклинических испытаний.
- В настоящее время в мире разрабатываются и проходят оценку клинической эффективности различные тест-системы (на основе методов мультиплексной qПЦР, NGS, биочипов, различных вариантов иммунофлуоресцентного анализа, масс-спектрометрии и др.), которые можно условно разделить на три группы, направленные выявление патогена, детерминант его патогенности и лекарственной устойчивости на основе анализа генома возбудителя; диагностику инфекционных заболеваний на основе молекулярных маркеров (белковых биомаркеров, мРНК, микроРНК и их паттернов) организма-хозяина; анализ факторов генетической предрасположенности к развитию инфекционных заболеваний.
Другим перспективным направлением является интегративное изучение различных видов иммунного ответа (врожденного, клеточного и гуморального) с использованием омиксных технологий и методов системной биологии.
- В частности, исследованы вакцины против гриппа, гепатита Б, кори и краснухи. Всего описано 927 геномных вариантов в 379 генах. Однако авторы отмечают, что для многих других заболеваний данных по анализу генетических детерминант иммуногенности вакцин недостаточно и необходимы дополнительные исследования и инвестиции.
- Перспективными направлениями являются, например, «системная серология», изучающая спектр антител в ходе иммунного ответа, иммунопептидомика и анализ популяций клеток иммунной системы, а также анализ метаболических изменений, вызванных вакцинацией.
- Полученная информация может послужить основой разработки персональных рекомендаций по применению вакцин с учетом их иммуногенности, побочных эффектов, типа и дозы для конкретного пациента.
- Проведен дизайн аптамеров-олигонуклеотидов, связывающихся со спайк-белком SARS-CoV-2 .
- Определен молекулярный механизм антибиотикорезистентности к цефтриаксону в мутантных бактериальных штаммах, вызванный появлением аминокислотных замен в пенициллин-связывающих белках второго типа.
- Определен молекулярный механизм репозиционирования терапевтического средства унитиола для борьбы с бактериальными инфекциями.
- Так, например, анализ единичных нуклеотидных замен в гене TRPV-1, кодирующем рецептор, участвующий в иммунном ответе, позволяет определить сопротивляемость организма при заражении вирусом SARS-CoV-2 .
- Похожие исследования также показали важность полиморфизма ACE1.
- Анализ вирусных геномов вариантов SARS-CoV-2 определил нуклеотидные замены, приводящие к резистентности к моноклональным антителам, другими словами продемонстрировано, что моноклональные антитела не всегда будут эффективными при лечении этого заболевания .
Анализ полноты исследований экспертной группой
В области поиска соединений с антибактериальной активностью есть некоторые успехи, однако требуется дальнейшее развитие данной области, так как многие соединения не продвигаются дальше лабораторных исследований.
В области поиска новых молекул успехи невелики, так как большая часть найденных молекул ранее была обнаружена, но в большинстве случаев не были достаточно охарактеризованы (не был известен механизм их действия и не исследован токсический эффект на эукариотических клетках).
Для обнаружения новых молекул необходимо расширить ареал поиска. Это можно сделать за счет отправки новых экспедиций в малоисследованные точки планеты и привлечения людей к проектам по «гражданской науке».
Исходя из представленного списка научных тематик, можно сделать вывод, что научные исследования и разработки по направлению «Связь генома человека и восприимчивости к инфекциям.
Персонализированная вакцинация» в России носят единичный характер. Практически все исследования носят поисковый характер. Ряд исследований нацелены на скрининг биологических маркеров при тех или иных инфекционных патологиях, однако полученных данных для клинического применения в большинстве случаев недостаточно.
Практически не проводятся исследования генетических факторов предрасположенности к развитию инфекционных заболеваний и вакцинации. Некоторые работы посвящены оценке иммунного ответа на противовирусные вакцины.
В ряде работ заявляется создание тест-систем для персонализированной диагностики, однако оценить их перспективы практического внедрения не представляется возможным.
Вместе с тем в России есть хороший технологический задел в области методов диагностики, в первую очередь молекулярной, которые могут быть использованы для создания тест-систем персонализированной диагностики инфекционных заболеваний.
Имеется также научный задел для создания различных типов противовирусных вакцин (живых, инактивированных, векторных, рекомбинантных, за исключением РНК-вакцин), которые могут применяться для вакцинации отдельных групп населения.
Также инициированы работы по оценке эффективности вакцинации против гриппа и COVID-19, учитывающие мировые критерии и подходы.
Специальные государственные программы, федеральные целевые программы, ведомственные программы и т.п.
Данные продукты успешно использованы для создания первых в РФ грибковых диагностических тест-систем (антигенных и антительных), которые также необходимы при мониторинге эффективности антигрибковых агентов. Работы в данных направлениях выполнены при поддержке крупными грантами РНФ, включая грант РНФ для лабораторий мирового уровня (№ 19-73-30017 и -30017-П, 2018–2025).
Разработка эффективных методов синтеза соединений указанных типов, различающихся размером и наличием узлов разветвления и активной спейсерной группы строго в определенном положении, занимает очень много времени. Но сейчас эта стадия НИР завершена, что и позволяет проводить препаративный синтез олигосахаридных лигандов фактически любого строения с последующим получением молекулярных зондов для отбора целевых антиген-распознающих рецепторов из соответствующих библиотек, а также сортинга B-лимфоцитов – продуцентов человеческих терапевтических противогрибковых моноклональных антител.
- Для поиска новых препаратов необходимо использование продуцентов из новых источников, поэтому нужно расширить ареал поиска с помощью отправки новых экспедиций для сбора образцов в малоисследованные места планеты, а также при помощи привлечения людей к проектам по гражданской науке.
- Сильная сторона подхода в том, что новое соединение может существенно помочь в борьбе с инфекциями, устойчивыми к антибиотикам, используемым в текущей практике.
- Слабой стороной является тот аспект, что поиск новых соединений – это вероятностный процесс, который не всегда увенчивается успехом.
- На первом этапе работы могут помочь различные репортерные системы, позволяющие на этапе скрининга отсортировать образцы с антибиотической активностью по механизму действия.
- В дальнейшем необходимо использовать хорошо зарекомендовавшие себя репортерные системы и разработать новые системы определения механизма действия антибиотиков.
- На дальнейших этапах необходимо применение широкого инструментария in vivo и in vitro методов, ассоциированных с конкретными мишенями в бактериальной клетке.
- Преимуществом данного подхода является тот факт, что антибиотики, с которыми ведется работа, уже есть в доступе. Однако недостатком является тот момент, что не всегда предсказанные in silico модификации соединений оказываются более эффективными, чем исходное соединение.
Проблема резистентности патогенных бактерий к антибиотикам приобрела характер глобальной мультифакторной угрозы, что вызывает увеличение смертности от инфекционных заболеваний и необходимость персонализированного лечения.
- В реализации разнообразных механизмов резистентности участвуют суперсемейства бактериальных ферментов.
- Важнейшим компонентом резистентности является суперсемейство бета-лактамаз, обусловливающих устойчивость бактерий к бета-лактамным антибиотикам – наиболее широко используемому классу антибактериальных препаратов. Данное суперсемейство объединяет гидролазы, содержащие серин или цинк в активном центре и различающиеся по структуре, каталитической активности, специфичности и стабильности.
- Особую угрозу представляют патогенные бактерии с множественной устойчивостью к антибиотикам, которые имеют гены нескольких бета-лактамаз разной специфичности. Для их подавления необходимо развивать новые подходы, основанные на создании универсальных многофункциональных ингибиторов, способных подавлять сериновые, металло-бета-лактамазы и пенициллин-связывающие белки. Такими свойствами обладают бороновые кислоты, которые могут связываться с активными центрами указанных белков и ингибировать три основные мишени как самостоятельно, так и в комплексе с бета-лактамами последних поколений (карбапенемами и монобактамами).
СССР был лидирующей страной в области разработки терапевтических бактериофагов. Лидерство было утеряно в связи с неоправданным копированием утвердившихся на Западе принципов испытаний и регистрации лекарственных препаратов. В результате применения этих принципов существующая сегодня в РФ разрешительная система блокирует применение бактериофагов в медицине.
- В то же время в США, странах Европы и в Австралии медицинское сообщество осознало неприменимость стандартной разрешительной системы к бактериофагам. Для применения бактериофагов были разработаны специальные правила, они все более упрощаются, и фаготерапия в этих странах быстро развивается.
Главное, что нужно сделать безотлагательно – изменить подходы к испытанию и регистрации бактериофагов.
- Они должны рассматриваться не как химические соединения фиксированной структуры, а как биологические объекты.
- Биотехнологические центры, располагающие соответствующей базой, должны получить разрешение производить бактериофаги используя утвержденные протоколы. Безопасность бактериофагов гарантируется их 100-летним применением, не выявившим каких-либо вредных эффектов этих агентов.
- Важные вызовы сегодняшнего дня – необходимо поддержать проекты по разработке технологий получения бактериофагов с заданными свойствами методами синтетической биологии, а также работы по созданию технологий производства бактериофагов в бесклеточных системах.
Значение инвазивных микозов как коморбидных патогенов, осложняющих выздоровление при других заболеваниях, убедительно подтверждено в последние годы. Установлена четкая тенденция к более частому выделению возбудителей грибковых инфекций у больных, госпитализированных в отделения реанимации и интенсивной терапии, в особенности у пациентов с подтвержденным диагнозом COVID-19.
- Отмечено, что наличие грибкового патогена на фоне интенсивной антибактериальной и гормональной терапии основного заболевания существенно повышает риск смертности и последующих осложнений.
- У пациентов с COVID-19 ассоциированными пневмониями в диагностически значимых количествах доминируют дрожжевые грибы рода Candida и плесневые грибы рода Aspergillus.
Особую обеспокоенность вызывает новый грибковый инфекционный агент Саndida auris, описанный впервые в 2009 г. в Японии.
- По данным Минздрава России, в 2017 г. был зарегистрирован первый случай заболевания в РФ, вызванного С. auris (Москва). В период с 2017 по 2021 гг. в России выделено и охарактеризовано уже более 176 штаммов С. auris, среди них 92 штамма, полученных от пациентов с новой коронавирусной инфекцией.
- Одной из главных особенностей С. auris является трудности в диагностике и устойчивость к существующим антимикотическим препаратам. На фоне новой коронавирусной инфекции развились проблемы с другими новыми грибковыми патогенами, для которых еще не разработаны эффективные лекарства.
- Например, стала широко известна проблема в Индии из-за микозов, вызываемые мукоромицетами («черная плесень»). Эта инфекция также появилась и расширяется и в России, особенно в Южном федеральном округе.
Уже сейчас необходимо приступить к реализации цели – разработать инновационные технологии обнаружения и преодоления устойчивости микроорганизмов к антимикробным лекарственным средствам, пригодные к использованию на территории РФ для повышения эффективности оказания персонализированной медицинской помощи и снижения заболеваемости и смертности населения от инфекционно-воспалительных заболеваний.
- Разработка таких инновационных технологий будет способствовать снижению потенциального риска возникающих новых биологических угроз на территории РФ, противодействовать биотерроризму, способствовать развитию персонализированной медицины и профилактики инфекционно-воспалительных заболеваний (в том числе инфекций, связанных с оказанием медицинской помощи (ИСМП), и социально значимых инфекций), а также разработке и выпуску опытных партий инновационных импортозамещающих диагностических наборов и реагентов для применения в микробиологических и геномных методиках и технологиях.
- собрать коллекцию биологического материала (фекалии и др.), полученного от взрослого населения (здоровые добровольцы и пациенты с различными инфекционно-воспалительными заболеваниями, в том числе с ИСМП и социально значимыми инфекциями), и штаммов микроорганизмов, выделенных из собранных биоматериалов;
- создать алгоритмы анализа и прогнозирования распространения лекарственной устойчивости возбудителей инфекционно-воспалительных заболеваний в различных регионах РФ с применением географических информационных технологий;
- разработать эффективные молекулярно-биологические диагностические тест-системы для детекции и мониторинга устойчивости возбудителей инфекционно-воспалительных заболеваний человека к антимикробным лекарственным средствам на основании полученных данных метагеномного анализа резистома;
- разработать и провести исследования эффективности и безопасности альтернативных лекарственных средств (пробиотики, бактериофаги) для лечения инфекционно-воспалительных заболеваний;
- предложить единые принципы диагностики инфекционно-воспалительных заболеваний, персонализированного ведения пациентов, инфицированных резистентными формами микроорганизмов, и мониторинга потребления антимикробных лекарственных средств.
- Сильной стороной использования тестовых панелей генетических детерминант эффективности вакцинирования может быть относительная дешевизна и охват больших групп населения в ходе массовых кампаний по вакцинированию.
- Слабость такого подхода, как и у всех тестов генетических детерминант, основанных на статистическом анализе ассоциаций, заключается в недостаточно высокой точности результатов и отсутствии персонального подхода к пациентам, что с необходимостью требует развития фундаментальных исследований в данной области.
- В качестве возможных мероприятий предлагается организация массового забора биоматериала для последующего генотипирования с использованием NGS в ходе прививочных кампаний. В ходе такого исследования необходим также сбор клинической информации о результатах вакцинации и побочных эффектов. В ходе мероприятия будут сформированы когорты для последующего анализа ассоциаций и разработки панелей для генетического тестирования.
- Другим перспективным направлением является массовое HLA-типирование населения в масштабах различных регионов страны. Так как многочисленными исследованиями показано, что эффективность вакцин зависит от HLA-статуса пациента, полученные данные могут быть существенным компонентом при разработке новых вакцин.
- Связь генома человека и восприимчивости к инфекциям. Тест-системы «вакцинировать или нет».
- Ферменты бактериальных и вирусных патогенов как мишени для терапии.Блокада процессов, вызывающих резистентность. Разработка средств борьбы с резистентными патогенами, в том числе создание ингибиторов молекулярных насосов выброса (Multidrug Efflux Pumps).
- Диагностика бактериальной и грибковой лекарственной резистентности (новые методы, чипы) и средства элиминации устойчивой флоры.
- Иммуноферментное детектирование грибковых инфекций, а также биотехнологические методы профилактики и лечения инвазивных микозов: антигрибковая вакцина; терапевтические антитела, полученные с помощью В-клеточной технологии; CAR-T, нацеленные на грибковые клетки.
- Модуляция состава микробиоты посредством микробной терапии с использованием персонифицированных микробных препаратов (аутопробиотиков) или таргетных пробиотиков.
- Высокопроизводительные технологии, в том числе микрофлюидные, в качестве платформы для поиска новых действующих веществ (антибиотики/пробиотики), в случае антибиотиков изучение их механизма действия, анализа микробиома и дифференциальной диагностики.
- РНК-вакцины, пробиотические вакцины.
- Иммунологическая оценка эффективности препаратов.
- In silico дизайн новых препаратов.

мировых исследований
При этом в рамках клинических рекомендаций может быть предусмотрено несколько вариантов фармакотерапии. Однако очевидным пациентоориентированным подходом к ведению пациентов является персонализация выбора лекарственных препаратов и их режимов дозирования, которые должны обеспечить максимальную эффективность и безопасность лечения у конкретного пациента.
В мире и России активно изучаются фармакогеномные, фармакоэпигеномные и фармакометаболомные биомаркеры, которые отражают индивидуальные особенности фармакокинетики и фармакодинамики у конкретного пациента на разных уровнях: от генома и регуляции экспрессии соответствующих генов до «реализации» работы их продуктов (ферментов биотрансформации, транспортеров лекарств) в виде значений концентраций лекарственных препаратов и их метаболитов в биологических жидкостях.
При этом фармакогенетические/фармакогеномные биомаркеры могут быть отнесены к «априорным» биомаркерам (т.е. предсказывающим индивидуальные особенности фармакокинетики и фармакодинамики до назначения лекарственного препарата), а фармакоэпигеномные и фармакометаболомные – к «постериорным» биомаркерам (т.е. отражающие «текущие» индивидуальные особенности фармакокинетики и фармакодинамики на фоне назначения лекарственного препарата).
Разработанные алгоритмы персонализации, «упакованные» для удобства врача в виде компьютеризированных систем поддержки принятия клинических решений уже сейчас апробируются в условиях реальной клинической практики («клиническая валидация») и позволяют у пациентов повысить эффективность лечения, снизить частоту нежелательных реакций и экономические затраты на неэффективное лечение и коррекцию медикаментозных осложнений.
В России уже реализуются образовательные программы повышения квалификации для врачей и провизоров для формирования компетенций по использованию новых биомаркеров персонализации фармакотерапии для успешного их внедрения в медицинскую и фармацевтическую деятельность.
Также у пациентов из различных этнических групп, проживающих на территории России (изучено 20 этнических групп Кавказа, Поволжья, Сибири, Дневального Востока и Крайнего Севера) оценена этническая чувствительность к лекарственным препаратам и его основа – различная частота фармакогенетических биомаркеров у представителей разных этносов, в том числе в пределах одной расы (проект «Фармакогенетический атлас России»), при этом данные об этнической принадлежности пациента также включены в алгоритмы персонализации фармакотерапии.
Данные «Фармакогенетического атласа России» также используются для выбора приоритетных регионов России для внедрения подобного рода подходов.
- По сути в России реализуется методология создания и внедрения подобного рода алгоритмов персонализации назначения лекарственных средств у пациентов с различными заболеваниями – от изучения проблемы фармакотерапии в клинике и выбора биомаркеров-кандидатов (в том числе с помощью исследований in silico и in vitro) до их вывода в клиническую практику в рамках так называемого трансляционного цикла.
- По данной методологии разработаны и внедрены алгоритмы персонализазации фармакотерапии на основе фармакогенетических/фармакогеномных биомаркеров у пациентов, принимающих антитромботические, психотропные, антигипертензивные, обезболивающие, антиксекреторные, противотуберкулезные, противовирусные (при COVID-19) противоглаукомные препараты, а также препараты, применяемые при заболеваниях ЖКТ, бронхиальной астме и в онкологической практике.
- Фармакогенетические исследования в области кардиологии продвинулись далеко вперед по сравнению с другими терапевтическими направлениями. Это обусловлено тем, что кровотечения, связанные с применением антитромботических препаратов, являются самой частой причиной смерти и госпитализаций пациентов в мире, при этом при неэффективности данной терапии возрастает риск тромбозов, нередко приводящих к инвалидности и смерти.
- Статус внесения фармакогенетического биомаркера в регламентирующие документы (в российские клинические рекомендации, утвержденные Минздравом) имеет именно фармакогенетическое тестирование по CYP2C19 для прогнозирования резистентности к клопидогрелу у больных острым коронарным синдромом.
- Данная научная тема выполняется в Российской медицинской академии непрерывного профессионального образования Минздрава России при поддержке Государственного задания.
- В этой связи разработка «Фармакогенетического атласа России» позволяет выявить закономерности в распределении частот аллелей, что подчеркивает необходимость учитывать этническую принадлежность при выборе препарата.
- изучение фармакогенетических маркеров эффективности и безопасности антитромботической терапии, в том числе у женщин с механическими протезами клапанов сердца во время беременности и послеродовом периоде;
- изучение фармакогенетических маркеров эффективности и безопасности антигипертензивных препаратов.
- изучение фармакогенетических маркеров эффективности и безопасности терапии антипсихотиками;
- изучение фармакогенетических маркеров безопасности терапии анксиолитиками;
- создание банка инновационных нейропсихиатрических исследований с отдельным направлением «Биомаркеры и персонализированная нейропсихофармакотерапия».
- изучение фармакогенетических маркеров эффективности противоопухолевой терапии у беременных пациенток с онкологическими заболеваниями;
- изучение фармакогенетических маркеров ответа на лечение и токсичности противоопухолевой лекарственной терапии у больных колоректальным раком;
- изучение маркеров эффективности и безопасности терапии ингибиторами контрольных точек иммунитета у больных раком почки.
- изучение фармакогенетических маркеров безопасности антиретровирусных препаратов;
- изучение фармакогенетических маркеров эффективности и безопасности противотуберкулезной терапии;
- изучение фармакогенетических маркеров безопасности противоковидных препаратов;
- изучение мутаций вируса гепатита С для прогнозировани ответа на противовирусные препараты прямого противовирусного действия.
- изучение фармакогенетических маркеров эффективности и безопасности гипогликемической терапии;
- разработка персонализированной схемы лечения ожирения в зависимости от молекулярных маркеров;
- изучение фармакогенетических маркеров эффективности антисекреторной терапии у больных с хеликобактерной инфекцией;
- изучение фармакогенетических маркеров, ассоциированных с течением муковисцидоза.
· персонализированный подход к назначению антиагрегантов у пациентов с сердечно-сосудистыми заболеваниями;
· персонализированный подход к лечению пациентов с семейной гиперхолестеринемией.
· персонализированный подход к назначению антипсихотиков у больных шизофренией, а также у пациентов с острыми алкогольными галлюцинозами;
· изучение эффективности и безопасности персонализированной фармакотерапии эпилепсии.
· изучение кардиоваскулярной токсичности, индуцированной химиотерапией и таргетными препаратами;
· исследование генетических маркеров остеопороза у онкогематологических больных;
· персонализированный подход к фармакотерапии хронического болевого синдрома у пациентов с раком поджелудочной железы.
· персонализированный подход к лечению пациентов с хронической болезнью почек, осложненной вторичным гиперпаратиреозом;
· персонализированный подход к лечению пациентов с нарушениями углеводного обмена;
· персонализация антигистаминной терапии бронхиальной астмы с помощью фармакогенетики;
· персонализация обезболивающей терапии у пациентов ортопедического и ревматологического профилей;
· создание алгоритмов персонализированной терапии ишемической болезни сердца, бронхиальной астмы, дорсопатии, инфекции мочевыводящих путей, пневмонии при новой коронавирусной инфекции, внутриутробных инфекций, туберкулеза.
· персонализированный подход к лечению пациентов с доброкачественной гиперплазией предстательной железы;
· персонифицированная тактика хирургического лечения больных с эхинококкозом печени;
· создание фармакогенетического атласа РФ;
· разработка набора реагентов для выявления предрасположенности к заболеваниям и генетических нарушений метаболических процессов в организме человека.
Для ПМ перспективны такие научные исследования, цель которых заключается в разработке моделей персонализации фармакотерапии, учитывающей как негенетические (клинические, демографические, инструментальные, лабораторные), так и генетические факторы, внедрение которых направленно на снижение риска нежелательных реакций или резистентности к терапии лекарственными препаратами.
- Примером подобного успешно реализованного алгоритма является многофакторная модель прогнозирования персональной дозы варфарина с учетом генетических особенностей, представленная в виде онлайн калькулятора, позволяющая быстрее, чем в рутинной практике, подобрать дозу препарата, снизить риски кровотечений и затраты на оказание медицинской помощи.
- Так, при проведении клинико-экономического анализа было показано, что фармакогенетическое тестирование для выбора дозы дабигатрана позволяет снизить стоимость фармакотерапии за счет снижения риска кровотечений.
Итогом фармакогенетических исследований для препаратов и нозологий, для которых обоснована целесообразность применения фармакогенетического подхода, является внесение этих методов в разрабатываемые регламентирующие документы – клинические рекомендации профильных сообществ, одобренные Министерством здравоохранения РФ, стандарты оказания медицинской помощи.
- Пример биомаркера, включенного в российские клинические рекомендации – фармакогенетическое тестирование по CYP2C19 для прогнозирования резистентности к клопидогрелу у больных острым коронарным синдромом.
- Кроме того, в настоящее время трудовая функция, касающаяся использования технологий ПМ содержится в профессиональном стандарте врача клинического фармаколога (трудовая функция А/03.8.8: «Персонализированный выбор и применение лекарственных препаратов на основании результатов фармакогенетического тестирования и (или) терапевтического лекарственного мониторинга»).
- В Российской медицинской академии непрерывного профессионального образования (РМАНПО Минздрава России) с 2014 г. разработана и реализуется программа повышения квалификации для врачей «Клиническая фармакогенетика с основами персонализированной медицины».
- С 2020 г. на базе Академического образовательного центра фундаментальной и трансляционной медицины РМАНПО реализуется междисциплинарная программа повышения квалификации для врачей «Фундаментальные основы персонализированной медицины в онкологии», а с 2023 г. начата реализация серии программ повышения квалификации для врачей в области подготовки специалистов по различным направлениям геномной медицины (гастроэнтерология, нефрология, онкология, психиатрия и наркология, кардиология) с использованием дистанционных образовательных технологий (автономное обучение).
- С 2014 г. РМАНПО совместно с Обществом фармакогенетики, фармакокинетики и персонализированной терапии, Ассоциацией клинических фармакологов проводятся ежегодные Всероссийские школы для молодых ученых и врачей по фармакогенетике, фармакогеномике и персонализированной терапии. Целью мероприятия является объединение экспертного сообщества и молодых ученых и врачей, которые только входят в научную деятельность, создание уникальной площадки для общения специалистов в области фармакогенетики в России, а также создание новых научных коллективов и консорциумов.
Таким образом, происходит непрерывное накопление доказательной базы исследований в области фармакогенетики и фармакогеномики, что способствует постепенному внедрению персонализированных подходов в клиническую практику.
Необходимо отметить, что для системного развития данного направления в России, а также координации совместной деятельности необходимы советы, объединяющие лидирующие научные и клинические учреждения, такие как Совет РАН по ПМ.
2. Eckman M.H., Rosand J., Greenberg S.M. et al. Cost-effectiveness of using pharmacogenetic information in warfarin dosing for patients with nonvalvular atrial fibrillation // Ann Intern Med. 2009; 150:73-83. DOI: 10.7326/0003-4819-150-2-200901200-00005
3. Сычев Д.А., Иващенко Д.В., Русин И.В. Влияние использования фармакогенетического тестирования на риск развития кровотечений и эпизодов чрезмерной гипокоагуляции при применении варфарина: первый метаанализ отечественных проспективных исследований // Терапевтический архив. 2014, 86(4), 64-71.
- Guideline on good pharmacogenomics practice. Draft. European Medicines Agency. 28 April 2016.
- Clinical Pharmacogenomics: Premarket Evaluation in Early-Phase Clinical Studies and Recommendations for Labeling. Guidance for industry. Food and Drug Administration. January 2013.
- Сычев Д.А., Иващенко Д.В., Мирзаев К.Б. Методология проведения клинических исследований вобласти персонализированной медицины: фокус на фармакогенетику // Вестник Росздравнадзора. 2018; 2: 40-47.

Применение искусственного интеллекта в медицинской практике может повысить уровень качества и эффективности предоставляемой медицинской помощи, обеспечивая персонифицированный подход. Тем не менее внедрение технологии искусственного интеллекта в рутинную медицинскую практику сопряжено с потенциальными негативными последствиями.
В связи с этим необходимо разрабатывать медицинские приложения на основе искусственного интеллекта в соответствии с юридическими и этическими нормами.
- В РФ понятие «искусственный интеллект» определено подпунктом а) пункта 5 Раздела I «Национальной стратегии развития искусственного интеллекта на период до 2030 года», утвержденной Указом Президента РФ от 10 октября 2019 г. № 490 «О развитии искусственного интеллекта в Российской Федерации».
- Распоряжением Правительства РФ от 19.08.2020 г. № 2129-р утверждена «Концепция развития регулирования отношений в сфере технологий искусственного интеллекта и робототехники до 2024 года».
- Внедрено семейство государственных стандартов ГОСТ Р 59921.Х-2022 «Системы искусственного интеллекта в клинической медицине». Применение ИИ в медицинских изделиях регламентируется Постановлением Правительства РФ от 24.11.1920 г. № 1906.
- Приказом Минздрава России от 07.07.2020 № 686н все медицинские изделия с применением ИИ отнесены к наивысшему 3 классу потенциального риска применения.
В сфере здоровьесбережения и здравоохранения тремя ключевыми игроками в сфере технологий на основе ИИ являются :
1. Здравоохранение, общественное здравоохранение и исследовательское сообщество в целом, включая врачей различных клинических специальностей, медсестер, администраторов, исследователей, фармацевтов, сотрудников лабораторий, руководителей и других медицинских работников.
2. Разработчики решений для информационных технологий здравоохранения и технологий ИИ.
3. Конечные пользователи – потребители услуг здравоохранения и общественного здравоохранения (пациенты, включая детей, членов семьи, лиц, обеспечивающих уход, и общественность в целом).
Каждая группа играет решающую роль в обеспечении продуктивного, безопасного и этичного использования ИИ для обмена и использования информации, связанной со здоровьем.
Как научная медицинская дисциплина ИИ включает в себя несколько подходов и методов:
· Машинное обучение (глубокое обучение и обучение с подкреплением). Например, распознавание и интерпретация диагностических изображений, анализ электронных медицинских карт.
· Робототехника (управление, восприятие, датчики и исполнительные механизмы, интеграция всех остальных технологий в киберфизические системы). Например, автоматические инъекции, наблюдение за оборудованием, роботизированная хирургия.
Прогресс машинного обучения стал причиной большинства последних достижений в этой области. Обычно ML относится к системе, которая обучает прогностическую модель, выявляя шаблоны из входных данных, и затем применяет полученные знания для создания полезных прогнозов на основе новой, ранее неизвестной информации.
Ключевой особенностью алгоритмов машинного обучения является возможность создания систем, автоматически совершенствующихся на основе опыта, без явного программирования.
Наиболее распространенными алгоритмами машинного обучения являются:
- обучение с учителем,
- обучение без учителя,
- обучение с подкреплением
- глубокое обучение].
- Методы контролируемого машинного обучения работают путем определения корреляции ввода-вывода на этапе «обучения» и использования выявленной корреляции для прогнозирования правильного вывода новых случаев[4].
- Этот тип машинного обучения широко применяется в здравоохранении, обеспечивая поддержку принятия клинических решений на основе данных для сопоставления входных переменных с дискретными категориями (например, структурированные данные в радиологических изображениях для диагностики и определения стадии опухоли) и прогнозную аналитику в рамках непрерывного вывода (например, оценка личного риска и прогноз на основе неструктурированных данных в электронных медицинских картах).
- Неконтролируемое машинное обучение позволяет создать алгоритм, который может находить подкластеры исходных данных, выявлять выбросы в данных или создавать низкоразмерные представления данных[5].
- Этот тип машинного обучения не получил широкого распространения в здравоохранении – он более подвержен ошибкам, поскольку может использовать тривиальные особенности данных для прогнозирования. О
- дним из немногих приложений является прогнозирование индивидуальных рисков заболеваний с использованием генетических биомаркеров или разработка персонализированных методов лечения на основе геномных вариаций.
Обучение с подкреплением – более автономный алгоритм обучения, который позволяет модели выполнять действия и взаимодействовать с окружающей средой, используя вознаграждения и ошибки в качестве обратной связи для своего обучения[1]. В здравоохранении обучение с подкреплением применимо в ситуациях, когда ИИ необходимо постоянно взаимодействовать с окружающей средой и корректировать свои действия на основе обратной связи. Поэтому это могут быть задачи по оптимизации или планированию лечения (медикаментозной терапии) или роботизированной хирургии, манипуляциям и диагностике (например, внутривенные инъекции, ультразвуковые исследования).
[1] Chen M., Decary M. Artificial intelligence in healthcare: An essential guide for health leaders // Healthc Manage Forum. 2020 Jan;33(1):10-18. DOI: 10.1177/0840470419873123.
[1] Yu K.H., Beam A.L., Kohane I.S. Artificial intelligence in healthcare // Nat Biomed Eng. 2018 Oct;2(10):719-731. DOI: 10.1038/s41551-018-0305-z.
[2] Chen M., Decary M. Artificial intelligence in healthcare: An essential guide for health leaders // Healthc Manage Forum. 2020 Jan;33(1):10-18. DOI: 10.1177/0840470419873123.
[3] Jussi Tohka, Mark van Gils. Evaluation of machine learning algorithms for health and wellness applications: A tutorial // Computers in Biology and Medicine. 2021. Vol. 132, 104324. DOI: 10.1016/j.compbiomed.2021.104324.
[4] Yu K.H., Beam A.L., Kohane I.S. Artificial intelligence in healthcare // Nat Biomed Eng.
[5] Yu K.H., Beam A.L., Kohane I.S. Artificial intelligence in healthcare // Nat Biomed Eng.
Применение технологий ИИ в здравоохранении позволяет создавать новые эффективные и результативные технологии профилактики и лечения заболеваний, а также технологии управления общественным здравоохранением.
С начала 2000-х гг. росла активность исследователей в сфере применения технологий ИИ в медицине. По результатам анализа в единой библиографической и реферативной базе рецензируемой научной литературы Scopus, с 2000 по 2021 гг. в мире опубликовано 5019 оригинальных научных статей по результатам исследований применения технологий ИИ в здравоохранении. В среднем темпы роста публикации научных работ по исследованиям ИИ в здравоохранении в период с 2000 по 2021 гг. составили 37,88 %.
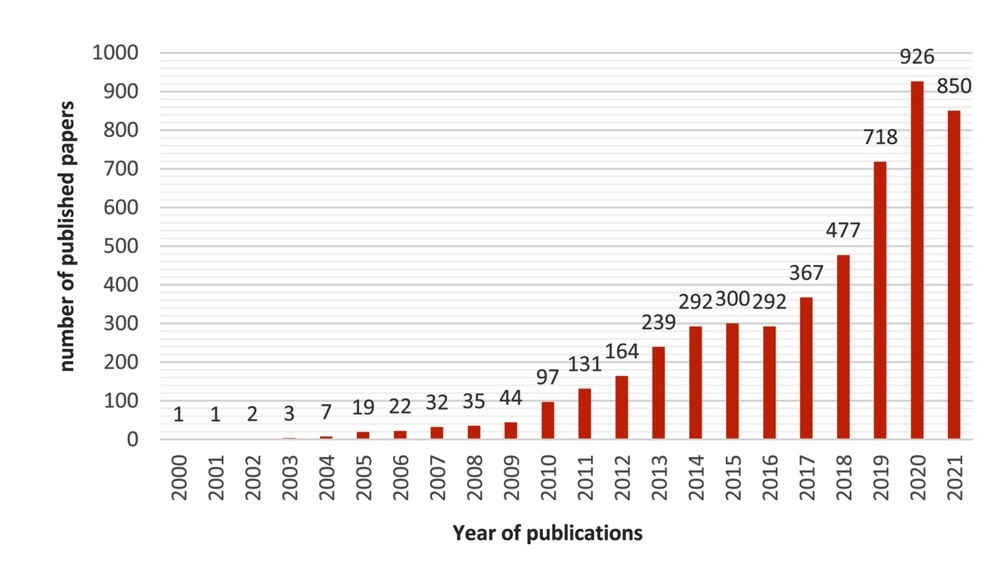
Помимо диагностики заболеваний технологии компьютерного зрения используются также при подготовке к оперативным вмешательствам, позволяя проводить моделирование операций.
Автоматические чат-боты для поддержки пациентов помогают сократить количество очных визитов к врачу, тем самым экономя существенные финансовые ресурсы. При этом повышается и приверженность пациентов к соблюдению назначенного лечения.
Технологии обработки естественного языка могут также применяться в исследованиях на основе информации из социальных сетей о состоянии здоровья и о развитии инфекционных и неинфекционных эпидемий. Популяционные исследования с применением технологий ИИ могут предложить решения, обеспечивающие улучшение показателей заболеваемости и смертности на национальном уровне.
- справочно-информационную поддержку;
- помощь в оформлении медицинской документации;
- ассистирование в диагностике и выявлении заболеваний на ранних стадиях;
- определение степени и тяжести заболеваний;
- прогнозирование развития заболевания, в том числе с учетом плана лечения, составление оптимального плана оказания медицинской помощи;
- генерацию тревожных сигналов;
- оценку квалификации медицинских работников.
В будущем генеративный ИИ может применяться для создания обучающего контента.
Цифровые двойники в медицине позволяют изучать, создавать и проверять новые гипотезы, а также проводить эксперименты и исследования in silico. Цифровые двойники начинают применяться в клинической медицине для тестирования новых методов лечения и реакции на них организма, моделирования работы органов и тканей. Такие технологии применяются в онкологии, эндокринологии, кардиологии, гастроэнтерологии, медицинской реабилитации, интенсивной терапии.
Моделью для исследования может быть живая клетка, ткань, орган, система, организм, медицинское учреждение и система здравоохранения в целом. Целью может служить моделирование поведения и выбор оптимальных сценариев воздействия на систему с целью индивидуального лечения заболеваний до повышения эффективности работы медицинских учреждений и системы здравоохранения в целом.
[2] Isomorphic Labs. URL: https://www.isomorphiclabs.com.
[3] First AI-generated small molecule drug enters Phase II trial. URL: https://www.europeanpharmaceuticalreview.com/news/184106/first-ai-generated-small-molecule-drug-enters-phase-ii-trial/.
- Накопление знаний обусловило создание новых технологий применения ИИ в здравоохранении. С 2015 по 2021 гг. количество полученных патентов в этой области в мире удваивалось ежегодно и достигло к июлю 2022 г. 10 967 патентов. Больше всего патентов зарегистрировано в Китае – 7332 (66,9 %), США – 2768 патентов (25,2 %), Южной Корее – 513 (4,7 %), Европейском патентном офисе – 191 (1,7 %), Японии – 163 (1,5 %).
- Компании, получившие максимальное количество патентов: Ping An Medical and Healthcare Management Co Ltd (Китай) с 568 (5,2 %) патентами, Siemens Healthineers с 273 (2,5 %), IBM Corp с 226 (2,1 %), Philips Healthcareсо 150 (1,4 %) и Shanghai United Imaging Healthcare Co Ltd (Китай) со 144 (1,3 %).
- Быстрое развитие технологий обуславливает ускоренное выведение на медицинский рынок медицинских изделий, использующих ИИ как конкурентное преимущество.
- Количество устройств с ИИ и машинным обучением, рассмотренных агентством Food and DrugAdministration (FDA) (Управление по контролю качества пищевых продуктов и лекарственных средств, США), увеличилось более чем в два раза с 2017 по 2018 гг. и с тех пор продолжает расти каждый год. В 2021 г. FDA одобрило рекордное количество заявок – 115, что на 83 % больше, чем в 2018 г.
- На примере США видно, что подавляющее большинство технологических решений в области ИИ использовалось в радиологии (392 или 76,7 %) и кардиологии (57 или 11 %).
Это прежде всего решения с использованием технологий компьютерного зрения. Для «обучения» нейронных сетей по технологии компьютерного зрения нужны тысячи графических изображений (снимки КТ и МРТ, кардиограммы), в то время как для разработки систем на основе других технологий, например, систем поддержки принятия врачебных решений и технологий обработки естественного языка, часто необходим доступ к десяткам миллионов историй болезни, что для большинства разработчиков недоступно.
- создание и развитие референтных центров по медицинским специальностям в первую очередь в радиологии и патоморфологии;
- стандартизация ИИ;
- создание федерального репозитария медицинских наборов данных (дата-сетов);
- разработка и внедрение систем автоматической генерации моделей ИИ;
- разработка и внедрение систем автоматической разметки данных;
- разработка систем поддержки принятия врачебных решений по медицинским специальностям;
- внедрение технологий ИИ в персональных медицинских помощниках;
- развитие центров испытаний систем ИИ;
- совершенствование непрерывного мониторинга, оценки и испытаний систем ИИ;
- развитие образования врачей в области интеллектуальной обработки данных и подготовка специалистов инженерных специальностей.
Можно также отметить потенциал в области философских исследований, который с успехом может быть использован применительно к гуманитарным и социокультурным вопросам развития кибернетики, компьютерной науки, науки о данных, ИИ.
На стыке компетенций специалистов в области этики и инженеров практиков в России формируется сбалансированное понимание того, как этические концепции и теории могут быть сконфигурированы, вследствие чего будет получено развитие в сфере ИИ. При этом упор делается на выверенные научные обоснования, доказательную базу, эффективные инструменты измерения, предметную онтологию, всесторонний анализ потенциальных последствий инженерно-технических решений, тщательное предварительное тестирование гипотез.
В рамках развития этической составляющей, морально-нравственных подходов к развитию ИИ-технологий основными отправными точками являются следующие подходы:
- ИИ следует рассматривать в общей парадигме развития экосистемы сквозных цифровых технологий, в этой связи целесообразно опираться и постепенно развивать уже существующий базис этических норм и стандартов, которые применимы к области информационно-коммуникационных технологий, компьютерным наукам, данным. Следует обращаться к этическим практикам и инструментам, которые уже наработаны в кибернетике, медицине, биотехнологии и генетике, гармонизировать их применительно к взаимопроникающим конвергентным технологиям и современным научно-техническим и гуманитарным вызовам.
- Идти по пути разумного применения универсальных норм и предметных, отраслевых этических подходов, которые учитывают специфику определенных классов моделей/систем ИИ и среду их применения (домен). В этом контексте рядом российских авторов предложены подходы для развития отраслевой кодификации этики в области ИИ. Такая модель позволит прицельно и предметно-ориентированно оценить потенциальное воздействие на человека и общество конкретных продуктов и изделий в определенных условиях эксплуатации и применительно к конкретным ситуациям. В этой связи можно подчеркнуть важность отдельных профильных исследований именно в медицинской сфере.
- Исходить из многообразия выработанных человечеством этических концепций и теорий, избегать попыток поспешной универсализации и шаблонности, учитывать культурные, исторические, духовно-мировоззренческие и религиозные особенности стран, народов и этносов, сложную, многогранную внутреннюю природу самого человека, его представления о благе и справедливости.
Создаваемые программные продукты анализируют изображения, полученные при рентгенологических, томографических, ультразвуковых, эндоскопических, офтальмологических, дерматологических, гистологических и микробиологических исследованиях, предсказывают течение болезни на основании клинических данных, генерируют 3D-модели имплантов, предлагают решения в области психотерапии.
Разработки финансируются за счет внебюджетных средств и при грантовой поддержке, в том числе Фонда «Сколково», Фонда содействия инновациям, Российского фонда развития информационных технологий.
Несмотря на большое количество компаний, осуществляющих разработки в сфере использования ИИ в здравоохранении, в Государственном реестре медицинских изделий и организаций (индивидуальных предпринимателей), осуществляющих производство и изготовление медицинских изделий, зарегистрировано всего 11 медицинских изделий в виде программного обеспечения с использованием технологий ИИ, из них 9 изделий предназначены для анализа изображений (компьютерная томография, рентгеновские снимки), и 2 изделия анализируют клинические данные пациентов.
Все 11 изделий зарегистрированы коммерческими организациями. Разработанная Сеченовским университетом система поддержки принятия врачебных решений «Онкопро» находится на стадии подготовки к проведению клинических испытаний. Также в Институте персонализированной кардиологии Сеченовского университета разработаны системы поддержки принятия врачебных решений для пациентов с нарушением липидного профиля, а также при артериальной гипертензии. Проводится апробация продуктов, готовятся документы для получения прав интеллектуальной собственности.
Многие разработки не регистрируются отдельно, а становятся частью медицинских изделий, особенно использующих технологии визуализации для диагностики заболеваний.
В системе здравоохранения Москвы, по сообщению исполняющей обязанности заместителя Мэра Москвы в Правительстве Москвы по вопросам социального развития А.В. Раковой, широко используется 12 отечественных медицинских сервисов с технологиями ИИ. В медицинских организациях Москвы ИИ применяется в нескольких видах лучевых исследований: компьютерной томографии, рентгенодиагностике, маммографии и флюорографии.
Разработки по внедрению ИИ в медицине реализует ООО «СберМедИИ». Экосистемный интегратор создает Медицинский цифровой диагностический центр (MDDC). В состав MDDC входят алгоритмы, решающие широкий спектр клинических задач по анализу данных пациентов в медицинских информационных системах, диагностику патологий системы кровообращения на КТ-снимках головы, анализ маммографических снимков, ЭКГ, КТ легких, изображений кожи, аудиозаписей дыхания.
Существенно сдерживает разработку, государственную регистрацию и внедрение медицинских изделий с использованием технологий ИИ требование нормативных документов (п. 15.1.1 Приказа Минздрава России от 07.07.2020 № 686Н) об отнесении таких изделий к наивысшему, третьему классу потенциального риска.
Использование технологий ИИ в здравоохранении РФ сопровождается несколькими этическими проблемами, важными для обсуждения.
Первая проблема связана с недостаточностью научных доказательств эффективности и безопасности ИИ-систем в медицине. В мировой практике только недавно начали проводиться исследования, которые предоставляют убедительные данные о позитивном воздействии применения ИИ на клинически значимые результаты. Однако количество таких исследований пока остается недостаточным. В России эта проблема стоит более остро, поскольку научно обоснованные исследования влияния ИИ на работу здравоохранения проводятся только в рамках эксперимента по использованию инновационных технологий в области компьютерного зрения для анализа медицинских изображений и дальнейшего применения в системе здравоохранения Москвы, утвержденного приказом Департамента здравоохранения Москвы от 16 февраля 2023 г. № 134 («Московский эксперимент»), что считается недостаточным.
Другая этическая проблема связана с повышенным риском нанесения вреда здоровью пациентов при применении ИИ-систем по сравнению с традиционными медицинскими методами. Большинство ИИ-систем основаны на машинном обучении и используют наборы данных, которые могут иметь проблемы с качеством. Иногда эти наборы данных могут не включать представителей российской популяции, что повышает риск ошибок при работе ИИ-алгоритмов. Кроме того, отсутствие методических подходов, принятых в доказательной медицине, при создании и внедрении ИИ-систем может привести к недостаточной оценке рисков и побочных эффектов.
Третья этическая проблема заключается в высоком риске деградации точности ИИ-систем при их использовании в реальной клинической практике. Исследования, включая Московский эксперимент, указывают на то, что ИИ-системы могут потерять точность из-за изменений в практике здравоохранения, включая внедрение новых методов лечения и изменения в течении заболеваний пациентов. Это связано с тем, что алгоритмы машинного обучения подвержены воздействию внешних факторов.
Заслуживает внимания проблема ответственности за ошибочные решения, принятые медицинскими работниками на основе рекомендаций ИИ. Важно понимать, что ни одна ИИ-система не может гарантировать 100 % точность в своих решениях. Всегда существует вероятность ошибки, особенно если алгоритм не был надежно обучен на разнообразных данных. В случае возникновения медицинских ошибок при использовании ИИ-системы, ответственность в настоящее время лежит на медицинском работнике, который следовал рекомендациям ИИ. Однако многие специалисты предлагают вовлекать разработчиков ИИ-систем в процесс несения ответственности за возможные ошибки.
Еще одна проблема связана с «черным ящиком» в работе ИИ-систем. Многие алгоритмы машинного обучения, такие как искусственные нейронные сети, способны давать высокоточные результаты, но не могут объяснить, как они пришли к этим выводам. Это может вызывать недовольство и недоверие со стороны медицинских работников, которые могут не понимать, почему ИИ предоставил определенное заключение.
Есть проблема связана со страхами перед ИИ-системами. Некоторые медицинские работники и руководители в здравоохранении могут опасаться истинных целей и скрытых особенностей работы ИИ-систем. Существует мнение о том, что такие системы могут использоваться не только для поддержки врачей, но и для сбора статистики об ошибках, что может повлиять на работу врачей. Есть также опасения, что в будущем ИИ-системы могут заменить медицинских работников, что вызывает тревогу в профессиональном сообществе.
Наконец, проблема конфиденциальности медицинской информации также требует внимания. Для работы и обучения ИИ-систем необходим доступ к большим объемам медицинских данных. Несмотря на усилия по обезличиванию данных, всегда существует риск утечки персональных данных, что поднимает вопросы о безопасности и конфиденциальности.
Эти этические вопросы представляют собой сложные вызовы, которые требуют обсуждения, проведения дополнительных исследований, модернизации соответствующей нормативно-правовой базы для использования ИИ в медицине.
· Часы Verily Study Watch с монитором нерегулярного пульса – часы Study Watch представляют собой миниатюрное носимое устройство, которое непрерывно отслеживает ЭКГ и частоту сердечных сокращений, а также другие данные.
· Система Zeus Zio watch – служба Zio Watch используется у взрослых с фибрилляцией предсердий (ФП) или предрасположенностью к ФП для анализа ЭКГ и фотоплетизмограммы с целью выявления ФП.
· Apple Watch atrial fibrillation history feature – AFib History Feature анализирует данные частоты пульса с часов Apple для выявления нерегулярных сердечных ритмов, указывающих на МА, и предоставляет оценку времени, проведенного в МА. Она включает в себя медицинское приложение на Apple Watch, а также приложение на iPhone.
· Приложение Apple Irregular Rhythm Notification Feature (IRNF) – это медицинское приложение, которое анализирует данные о частоте пульса с Apple Watch и уведомляет пользователя о наличии МА.
· AliveCor KardiaMobile 6L и AliveCor QT – KardiaMobile 6L – это устройство для получения ЭКГ, которое врачи могут использовать для ручного измерения интервала QT своих пациентов. AliveCor QT Service – облачное программное обеспечение, которое предоставляет врачам QT с поправкой на частоту сердечных сокращений.
· Implicity IM007 – записывает и анализирует данные ЭКГ от вставляемых кардиомониторов (ICM), помогая диагностировать аритмии.
· Вставляемый кардиомонитор LINQ II, система классификации ЭКГ Zelda AI – ИКМ LINQ II представляет собой вставляемое устройство, записывающее ЭКГ. Он может быть активирован пациентом или включаться автоматически. Используется у взрослых с риском развития или симптомами аритмии.
· Zio ECG Utilization Software и AT ECG Monitoring System, Zeus System – обрабатывают данные ЭКГ с совместимых устройств мониторинга, позволяя выявлять аритмии (автоматически или путем анализа событий, вызванных пациентом). После сбора данных формируется отчет для просмотра врачом. Эти устройства используются для пациентов, подверженных риску возникновения аритмии или имеющих симптомы аритмии.
· VX1 – это программное обеспечение машинного обучения, которое помогает врачам идентифицировать внутрисердечные предсердные электрограммы, демонстрирующие пространственно-временную дисперсию во время процедуры абляции МА.
· RX-1 Rhythm Express Remote Cardiac Monitoring System – Rhythm Express – это система удаленного мониторинга сердца. Устройство подключается к стандартным электродам ЭКГ для снятия двухканальной ЭКГ. Встроенный алгоритм обрабатывает полученную ЭКГ для обнаружения аритмий, сжатия ЭКГ и удаления большинства внутриполосных шумов без искажения электрокардиограммы. Устройство может работать в одном из трех режимов: мобильная кардиотелеметрия, регистратор событий и беспроводной холтер, и может носиться пациентами до двух недель.
· Система удаленного мониторинга BodyGuardian – обнаруживает и контролирует сердечные аритмии у амбулаторных пациентов. Устройство использует коммерчески доступные внешние подключаемые устройства, такие как датчики ЭКГ, измерители артериального давления и пульсоксиметры.
· AI-ECG Tracker – использует машинное обучение для оценки данных амбулаторной ЭКГ с целью выявления аритмий у взрослых без кардиостимуляторов. Интерпретации программы анализа могут быть подтверждены, отредактированы, изменены или удалены квалифицированными врачами.
· AI-ECG Platform – использует машинное обучение для помощи врачам в интерпретации 12-отведений ЭКГ покоя. Интерпретация, выполненная аналитической программой, может быть подтверждена, отредактирована или удалена квалифицированными врачами.
· Программное обеспечение Eko Analysis Software – помогает в оценке сердечных шумов и ЭКГ пациентов. Программа выявляет подозрительные шумы, а также МА и нормальный синусовый ритм. Она может рассчитать частоту сердечных сокращений, длительность QRS и время электромеханической активации. Она не выявляет другие аритмии, кроме МА, и не определяет тип шумов.
· PhysIQ Heart Rhythm and Respiratory Module – используется для расчета частоты сердечных сокращений и вариабельности сердечного ритма, выявления МА и определения частоты дыхания путем автоматизированного анализа данных амбулаторной ЭКГ и трехосных акселерометров.
· Loop System – регистрирует артериальное насыщение кислородом, частоту сердечных сокращений и частоту дыхания у взрослых пациентов в домашних условиях. Эти данные впоследствии передаются на веб-сервер для удаленного просмотра врачом.
· KardiaAI – это библиотека программного анализа, которая помогает оценить ритмы ЭКГ (например, нормальный синусовый ритм, МА, брадикардия и тахикардия) на амбулаторных электрокардиограммах, записанных с различных устройств, включая регистраторы событий.
· RhythmAnalytics – это программное обеспечение, которое оценивает наличие сердечных аритмий по данным ЭКГ с одним отведением; клиницисты должны просматривать и подтверждать результаты анализа.
· Rx-1 Rhythm Express Remote Cardiac Monitoring System – система удаленного мониторинга сердца Rhythm Express обеспечивает непрерывный мониторинг ЭКГ, функционируя в одном из трех режимов: мобильная кардиотелеметрия, регистратор событий и беспроводной холтер.
· Cardio-TriTest v6.5 – объединяет результаты 12-отведений ЭКГ, 4-отведений фонокардиографа и 4-отведений механокардиографа в целостную презентацию, которая помогает врачу в диагностической интерпретации.
· FibriCheck – может использоваться пациентами для самоконтроля МА на периодической основе.
· Rooti Rx ECG Event Recorder, Rooti Link APP Software – система Rooti Rx позволяет амбулаторному пациенту записать однопроводную ЭКГ для просмотра ее поставщиком медицинских услуг.
· Peerbridge Cor(TM) System – представляет собой носимое устройство мониторинга, которое фиксирует, передает симптоматические события и непрерывные данные ЭКГ в течение 24 ч и до семи дней и предоставляет эти данные врачу для просмотра.
· CardioLogs ECG Analysis Platform – анализирует данные, записанные с совместимых устройств, используемых для диагностики аритмии (например, холтер, регистратор событий). С ней можно осуществлять электронное взаимодействие и проводить анализ данных, передаваемых с других компьютерных систем ЭКГ.
· Reveal LINQ – это небольшое устройство, помещаемое под кожу, которое непрерывно контролирует сердечный ритм в течение трех лет.
· FEops HEARTguide – выполняет компьютерное моделирование транскатетерной имплантации устройства для окклюзии левого предсердного придатка (LAAO) во время планирования процедуры. Он прогнозирует деформацию каркаса имплантата для определения размера и размещения устройства LAAO.
· Oxehealth Vital Signs – представляет собой программное обеспечение, которое анализирует видеозаписи для оценки частоты сердечных сокращений и дыхания пациента, когда он находится в неподвижном состоянии. Оно предназначено для использования в больничной палате или в других защищенных условиях, требующих, чтобы обученный специалист периодически проверял состояние пациента. Он не подходит для использования в условиях реанимации или у пациентов, нуждающихся в постоянном мониторинге жизненно важных показателей.
· Аналитика гемодинамической нестабильности (AHI) – программа используется у взрослых, получающих непрерывный мониторинг ЭКГ. AHI использует ЭКГ для характеристики гемодинамического статуса пациента и выявления признаков гемодинамической нестабильности.
· Система CLEWICU (ClewICUserver и ClewICUnitor) – используется в отделении интенсивной терапии (ОИТ) для прогнозирования вероятности гемодинамической нестабильности пациента в будущем.
· PeraMobile, PeraWatch, PeraServer, PeraTrend – эти устройства используются для отслеживания, мониторинга и отображения индекса Ротмана (RI) в условиях больницы. Индекс RI использует совокупность жизненно важных показателей, лабораторных значений и оценок медсестер для получения единого балла, который отражает риск смертности пациента.
· Biovitals Analytics (BA) Engine – используется с непрерывными данными о здоровье, собранными с помощью датчиков, которые отслеживают частоту сердечных сокращений, частоту дыхания и активность амбулаторных пациентов в медицинском учреждении или дома, в периоды минимальной активности. Устройство рассчитывает временной ряд Биовитального индекса (БИ), который является отражением разницы между измеренными жизненными показателями пациента и их предыдущими базовыми значениями.
· Индекс прогнозирования гипотензии и программное обеспечение Edwards Lifesciences Acumen Hypotension Prediction Index – позволяет определить вероятность того, что у пациента в будущем произойдет гипотензивное событие. Он используется у пациентов, получающих расширенный гемодинамический мониторинг, в сочетании с другой клинической информацией. Устройство состоит из программного обеспечения, сопряженного с внесосудистым датчиком артериального давления и радиальным артериальным катетером.
· WAVE Clinical Platform – это программное обеспечение, которое управляет и отображает информацию из различных источников, включая медицинские устройства, электронные медицинские карты и клинические информационные системы. Это платформа удаленного мониторинга, которая отображает физиологические данные, формы волны, сигналы тревоги, результаты и диагностическую информацию, направляемую через WAVE Clinical Platform от поддерживаемых устройств и систем. Клиническая платформа WAVE предназначена для использования в больничных или стационарных условиях.
· Стетоскоп Tyto – это электронный стетоскоп, который позволяет врачу, находящемуся в одном месте, слышать звуки аускультации пациента на месте или в другом месте в IP-сети. Он позволяет проводить четыре типа обследований: сердца, легких, пульса и аудио.
· Программное обеспечение PhysIQ Personalized Physiology Analytics Engine (PPA Engine) – это компьютерная аналитическая программа, предназначенная для выявления изменений во взаимосвязях между жизненными показателями пациента во время динамической физической активности на основе данных, поступающих от многопараметрических устройств мониторинга жизненных показателей.
· Visensia – Visensia with alert является программным дополнением к мониторам пациента (прикроватным или амбулаторным) и клиническим информационным системам и используется у взрослых пациентов, которым необходим многопараметрический мониторинг пациента.
· eMurmur Heart AI – программное обеспечение eMurmur Heart AI обеспечивает автоматизированный анализ записанных звуков сердца с помощью цифрового стетоскопа и определяет S1, S2, физиологические шумы в сердце, патологические шумы в сердце и отсутствие шумов в сердце.
· eMurmur ID – записывает, отображает и анализирует звуки сердца, записанные электронным стетоскопом, и определяет S1, S2, физиологические шумы в сердце, патологические шумы в сердце и отсутствие шумов в сердце.
· Stethee Pro 1, Stethee Pro Software System – это электронный стетоскоп, который используется для обнаружения, записи и усиления звуков, издаваемых сердцем, легкими, артериями, венами и другими внутренними органами. С помощью программного обеспечения Stethee Pro Software System данные можно анализировать и передавать другим авторизованным пользователям.
· Steth IO – стетоскоп и фонокардиограф StratoScientific Steth IO модель 1.0 используется для обнаружения и усиления звуков, издаваемых сердцем и легкими, с помощью селективных частотных диапазонов.
· HeartFlow Analysis – это программное обеспечение для моделирования, которое обеспечивает анализ данных КТ DICOM для оценки анатомии и функции коронарных артерий.
· CathWorks FFRangio – это программное обеспечение, которое обеспечивает анализ DICOM-данных отдельно полученной ангиографии для пациентов с САПР. Анализ FFRangio оценивает анатомию и функцию коронарных артерий и помогает в оценке САПР. Программа извлекает стандартные ангиографические изображения, на которых пользователь выбирает и отмечает целевое поражение, расположение остиума, магистральный сосуд, целевой сосуд и другие ключевые характеристики.
· HeartfFow FFRCT Analysis – это программное обеспечение для моделирования, которое анализирует отдельно полученные данные КТ DICOM для симптоматических, но клинически стабильных пациентов с САПР. Анализ FFRCT оценивает анатомию и функцию коронарных артерий, тем самым поддерживая оценку САПР. Существует также версия 2.0.
· Система Arterys Oncology DL может автоматически идентифицировать узлы легких (Lung-RADS) и поражения печени (LI-RADS) на основе изображений, полученных при КТ или МРТ. Он не только помогает сравнивать медицинские изображения различных модальностей с помощью 3D-визуализации, но и позволяет врачам редактировать автоматизированные сегменты, дополняя тем самым стандартные протоколы.
· cmTriage – этот алгоритм пассивного оповещения помогает радиологу определить приоритетность пациентов на основе сложных или подозрительных случаев, полученных на скрининговых цифровых маммограммах.
· Программное обеспечение ProFoundTM AI Software V2.1 для компьютерной диагностики, способное определять плотность и кальцификацию тканей молочной железы на основании трехмерных цифровых томограмм молочной железы. Алгоритм присваивает обнаруженной области баллы от 0 до 100, отражающие вероятность злокачественности.
· TransparaTM – программное обеспечение для поддержки принятия врачебных решений при раке молочной железы. Помогает проводить скрининг маммограмм, выявляя подозрительные участки мягких тканей и кальцификаты, и выдает оценку вероятности наличия злокачественной опухоли.
· QuantX – еще одна одобренная FDA система компьютерной диагностики рака молочной железы, которая помогает радиологам в оценке отклонений по данным МРТ молочных желез.
· RayCare – это система управления недиагностической информацией, включающая передачу, хранение, преобразование и визуализацию данных о пациенте. Позволяет планировать и управлять рабочим процессом, включая последующее наблюдение за пациентом на различных этапах противоопухолевого лечения.
· Программное обеспечение Quantib® Prostate (Quantib, Роттердам, Нидерланды) обеспечивает быстрое обнаружение изменений тканей простаты на МРТ. Приложение также помогает классифицировать найденные изменения по PI-RADS. Фармакокинетическая модель, используемая в Quantib® Prostate, помогает обнаружить новообразования и количественно оценить опухолевый неоангиогенез для определения степени агрессивности рака. Полученная информация позволяет проводить оценку и мониторинг солидных опухолей, таких как поражения предстательной железы, прямой кишки и печени.
· AI-Rad companion prostate MR компании Siemens Medical Solutions позволяет объединить данные МРТ иУЗИ. Современная модель диагностики рака предстательной железы включает проведение МРТ и биопсию опухоли под контролем УЗИ. Очаги поражения, обнаруженные на МРТ, описываются радиологом, после чего изображения накладываются на УЗИ и достигается слияние двух методов. ИИ в данном случае облегчает выполнение биопсии, позволяет сэкономить время и повысить ее точность.
· Система мониторинга глюкозы в крови One Drop – измеряет уровень глюкозы в крови по образцам крови, взятым из кончика пальца.
· Система мониторинга глюкозы в крови Dario – система мониторинга измеряет уровень глюкозы в крови. Приложение Dario App отображает результаты в режиме реального времени, а также предоставляет предупреждения и напоминания.
· WellDoc BlueStar – система надежно фиксирует и передает данные о глюкозе крови, помогая пациентам и их медицинским работникам в управлении диабетом. Она также предоставляет мотивационные и образовательные сообщения на основе значений глюкозы крови и тенденций, чтобы способствовать соблюдению режима приема лекарств.
· Система D-Nav – это программное обеспечение, предназначенное только для рецептурного использования и предоставления рекомендаций по следующей дозе инсулина в качестве вспомогательного средства для индивидуального управления инсулином.
· EndoTool SubQ – это программное обеспечение, которое дает рекомендации медицинскому работнику относительно следующей дозы подкожного инсулина для конкретного пациента.
· GI Genius – система используется для пациентов, проходящих эндоскопию с применением белого света, и обеспечивает компьютерное обнаружение поражений слизистой оболочки толстой кишки (например, полипов и аденом) в режиме реального времени.
· ACR | LAB Urine Analysis Test System – это набор (включающий цветную доску и полоски с реагентами) вместе с приложением для смартфона, который измеряет содержание альбумина и креатинина в моче и отображает результаты, а также соотношение альбумина и креатинина.
· DIP/U.S. Urine Analysis Test System – это набор (включающий цветную доску и полоски с реактивами) вместе с приложением для смартфона, который измеряет параметры мочи, включая pH, глюкозу, белок, удельный вес, кровь и нитраты, и предоставляет эти результаты непосредственно врачу для помощи в диагностике и мониторинге заболеваний почек.
· EyeBOX – анализирует движения глаз в качестве вспомогательного средства при диагностике сотрясения мозга в сочетании со стандартной неврологической оценкой.
· Система COMPLETE CONTROL Gen2 – используется в качестве блока управления для внешних протезов верхних конечностей. В ней используется технология распознавания образов для получения мышечных сигналов для управления протезами верхних конечностей.
· Sense System с электродами IBT – это система поверхностных электромиографических электродов, разработанная для улучшения управления протезами верхних конечностей.
· Persyst 14 EEG Review And Analysis Software – программное обеспечение помогает в анализе данных амбулаторной электроэнцефалографии (ЭЭГ).
· EyeArt – автоматически выявляет диабетическую ретинопатию (более чем легкую), а также более тяжелую диабетическую ретинопатию в глазах взрослых людей с диабетом, у которых ранее не была диагностирована диабетическая ретинопатия.
· Intelligent Retinal Imaging System (IRIS) – программное обеспечение IRIS представляет собой сервисное приложение, которое позволяет врачам сканировать сетчатку глаза пациента с помощью фундус-камеры, загружать изображения на веб-сайт и предоставлять интерпретацию снимков.
· Cognoa Autism Spectrum Disorder Diagnosis Aid – использует алгоритм машинного обучения, который объединяет информацию от опекунов и врачей для помощи в диагностике ASD. Он состоит как из программного обеспечения, так и из аппаратных платформ. Пользователи вводят данные через мобильное приложение, портал видеоаналитики и (или) портал медицинского работника.
· MATRx Plus – помогает в оценке нарушения дыхания во сне в домашних условиях, регистрируя дыхательный носовой поток, храп, насыщение крови кислородом, пульс, дыхательные усилия и положение тела во время сна.
· SnoreSounds – это приложение для смартфона для диагностики обструктивного апноэ сна. Программное обеспечение анализирует храп количественно и качественно.
· EnsoSleep – оценивает параметры сна для выявления нарушений сна, связанных с дыханием. Наряду со стадией сна, устройства определяют возбуждение, движения ног и дыхательные события, такие как обструктивные апноэ, центральные апноэ сна и гипопноэ.
· MIMOSA Imager – используется в амбулаторных условиях для оценки пространственного распределения процентного насыщения тканей кислородом во время обследования пациентов с подозрением на нарушение кровообращения.
Уровень и направления исследований и разработок с применением технологий ИИ в здравоохранении в РФ соответствует общемировым тенденциям. Факторами успеха внедрения технологий ИИ являются:
- признание государством важности развития технологий ИИ, в том числе в здравоохранении;
- широкое участие специалистов смежных специальностей (информатика, математика, физика);
- инвестирование в разработки организациями всех форм собственности в связи с возможностью коммерческого внедрения разработок.
- повышение доступности больших массивов данных для разработчиков;
- работа над качеством данных, собираемых в Вертикально-интегрированной медицинской информационной системе;
- упрощение процедуры регистрации медицинских изделий с применением технологии ИИ;
- повышение доверия к ИИ-системам за счет создания механизмов контроля за безопасностью и качеством технологических решений.
- создание персонализированных (в том числе аутологичных) клеточных продуктов и тканеинженерных конструкций для замещения тканей, утраченных в результате травм и заболеваний;
- развитие методов, основанных на индивидуальной оценке генетического профиля, с целью коррекции мутаций, вызывающих наследственные заболевания, в первую очередь для лечения болезней системы крови и нейродегенеративных заболеваний (в том числе с помощью редактирования генома);
- трансплантация аутологичных минимально манипулированных тканей для восстановления структур организма человека;
- развитие методов, основанных на использовании индуцированных плюрипотентных клеток, как источник материала для создания клеточных продуктов и тканеинженерных конструкций;
- создание персонализированных алгоритмов оценки индивидуального потенциала и эффективности клеточных аутологичных клеточных продуктов на основе генетического, транскриптомного профилирования и оценки эпигенетического статуса (в том числе с использованием «больших данных» и популяционной генетики).
Основные достижения ПМ и примеры успешной реализации в мире
Регенеративная биомедицина и создаваемая на основе ее подходов и достижений прецизионная (персонализированная) медицина – один из наиболее динамично развивающихся секторов экономики в развитых странах. Согласно данным Альянса по регенеративной медицине, несмотря на пандемию коронавирусной инфекции, только за первые три квартала 2020 г. инвестиции в этой области составили 15,3 млрд дол. США (по сравнению с 13 млрд в 2018 г.). Все крупные технологически развитые страны мира имеют в настоящее время свои долгосрочные государственные программы исследований в области регенеративной биомедицины.
Финансирование регенеративной медицины за последние 12 лет выросло с 723 млн дол./год до 1,07 млрд дол./год, финансирование исследований в области стволовых клеток выросло с 938 млн дол./год до 2,014 млрд дол./год. По проекту NIH RMIP было выделено 30 млн дол. в течение четырех лет на клинические исследования в области регенеративной медицины с использованием взрослых стволовых клеток. Общий фонд NIH, финансируемый ARRA (American Recovery and Reinvestment Act), поддерживает несколько исследовательских проектов, в которых исследуются различные подходы регенеративной медицины, включая репрограммирование взрослых стволовых клеток в клетки, подобные эмбриональным стволовым клеткам, и создание нейронов (нервных клеток) из ненейрональных клеток. NIH продолжает работать в тесном сотрудничестве с FDA США над внедрением RMIP. Был создан ресурс «катализатор инноваций в регенеративной медицине (RMIC)», финансируемый NIH. Он нужен для более эффективного внедрения безопасных и эффективных методов лечения на основе стволовых клеток взрослого организма в клиническую практику и дальнейшего развития области регенеративной медицины. При поддержке этого ресурса проводится углубленная характеристика исходных стволовых клеток и продуктов, полученных из стволовых клеток, которые будут вводиться пациентам, для предоставления технических и административных услуг, помогающих удовлетворить нормативные требования, а также предоставляются услуги по хранению и распространению результатов детальной характеристики клеток и клинических данных. Ожидается, что RMIC также предоставит платформу для обмена и анализа данных клинических исследований и данных о характеристиках клеточных продуктов, тем самым потенциально обеспечивая корреляцию характеристик стволовых клеток с клиническими результатами.
Программа по регенеративной медицине США (RMP) стартовала в 2010 г. и разрабатывает меры поддержки для терапевтического использования особого типа стволовых клеток, называемых индуцированными плюрипотентными стволовыми клетками (ИПСК). RMP включает две инициативы, запущенные в 2015 г.: Лаборатория трансляционных исследований в области изучения стволовых клеток (SCTL) в рамках Национального центра передовых трансляционных исследований (NCATS); «Премия по проблемам лечения заболеваний» (Therapeutic Challenge Award) доктора Капилу Бхарти (Dr. Kapil Bharti) в Национальном институте офтальмологии (NEI). RMP поддерживает распространение линий ИПСК, разработанных программой для лабораторных и клинических исследований. Программа по регенеративной медицине призвана ускорить прорыв в разработке методов лечения тяжелых заболеваний на основе использования стволовых клеток. В настоящее время деятельность SCTL направлена на решение проблем, препятствующих трансляции регенеративных разработок из лаборатории в клинику. SCTL ставит следующие цели для преодоления технических проблем использования ИПСК: установление подробных стандартов контроля качества для ИПСК человека и производных от них дифференцированных типов клеток; разработка методов оценки гетерогенности культивируемых клеток, полученных из ИПСК; разработка стандартизированных методов для получения зрелых клеток, соответствующих указанным стандартам контроля качества; обнаружение, проверка и распространение низкомолекулярных соединений для замены дорогостоящих рекомбинантных белков, ксеногенного материала и компонентов среды неизвестного происхождения в протоколах дифференцировки клеток.
Стратегическая цель IRMI заключается в создании инфраструктуры, которая будет способствовать развитию междисциплинарных исследований в области регенеративной медицины. Благодаря этой стратегии стимулируется разработка новых продуктов передовой терапии, что должно способствовать повышению международной конкурентоспособности продуктов на основе тканей и клеток человека, произведенных в Италии.
В рамках программы предполагается развитие существующих биобанков для хранения клеток и тканей; создание поддерживающих центров для проведения научных исследований и создания промышленных разработок продуктов для передовой терапии, включая проведение трансляционных клинических исследований; исследование в области разработки новых производных тканей человека, биосовместимых полимеров, клеточных продуктов на основе ИПСК, а также активных молекул, способных регулировать пролиферацию и дифференцировку стволовых клеток.
В рамках этой инициативы выделяют несколько ключевых направлений, в которых ожидается значительный прогресс в области регенеративной медицины:
- использование ИПСК;
- прямое репрограммирование дифференцированных клеток;
- взрослые стволовые клетки;
- генная терапия и генетически модифицированные клетки в качестве методов лечения (включая разработку средств доставки генной терапии);
- трансляционная наука и технологии, направленные на обеспечение успешной доставки и применения продуктов для регенеративной медицины;
- создание животных моделей для анализа специфической активности продуктов на основе клеток человека без риска отторжения.
- Carticel® (производитель Genzyme corp., США) – суспензия аутологичных хондроцитов;
- CaReS (производитель Arthro Kinetics, Германия) – матрикс из коллагена I типа из крысиных хвостов с аутологичными хондроцитами;
- Hyalograft C autograft (производитель Anika therapeutics, Великобритания) – матрикс из гиалуроновой кислоты с аутологичными хондроцитами;
- ARTROcell 3D® (разработчик и производитель co.don AG, Германия) – аутологичные хондроциты в виде микросфер;
- Cartilink™-1 (производитель Interface Biotech A/S, Дания) – суспензия аутологичных хондроцитов;
- NOVOCART™ (производитель Tetec Tissue Engineering Technologies AG, Германия) – суспензия аутологичных хондроцитов;
- CARTISTEM® (производитель MEDIPOST, Южная Корея) – аллогенные мезенхимальные стромальные клетки из пуповинной крови для лечения остеоартрита;
- БМКП «Мезенхимальные стволовые клетки» (Институт биофизики и клеточной инженерии НАН Беларуси, Беларусь) – аллогенные мезенхимальные стромальные клетки жировой ткани человека;
- ZYNTEGLO (разработчик и производитель Bluebird Bio, США) – аутологичные CD34+ клетки, несущие ген βA-T87Q-глобина;
- TECARTUS (разработчик и производитель Kite Pharma и Gilead, США) – CAR-T клеточная терапия для лечения мантийноклеточной лимфомы и острого лимфолейкоза;
- LIBMELDY (производитель Orchard therapeutics, Великобритания) – актологичные CD34+ клетки, несущие ген ARSA (арильсульфатаза А).
Тип клеток – аутологичные МСК костного мозга/жировой ткани, десны либо сфероиды на их основе. Тип операции – имплантация клеточного продукта в виде инъекции во вторичную рану после иссечения рубца голосовой складки, имплантация на коллагеновой матрице в область перфорации барабанной перепонки. Клеточный носитель – фибриновый гель, коллагеновая матрица. В реализации технологии производится оценка совокупности вариативных фенотипических признаков тканей и клеток индивидуального организма. Основа разрабатываемой технологии – создание индивидуальных биомедицинских клеточных продуктов на основе аутологичных МСК с учетом объема, характера и объема патологического процесса, локального и общего статуса здоровья пациента.
o Разработана уникальная технология, дающая возможность производить оптически прозрачные коллагеновые покрытия, на основании которых создается искусственная роговица.
Уровень технологической готовности (TRL) составляет 2–3. Разработана базовая лабораторная технология производства искусственных роговиц/офтальмологических покрытий. Требуется доработка технологии, исходя из результатов пилотных испытаний на животных, и оптимизация механических свойств, прозрачности, сроков биодеградации и прочее. После лабораторного пилотирования технологии потребуется проработка масштабирования технологии до промышленного производства и решение соответствующих технических/инженерных задач.
Ноу-хау технологии заключается в достижении прозрачности получаемых мембран (пропускание света >80 % при длине волны 550 нм) одновременно с сохранением механической прочности за счет уникального протокола их получения и обработки. Высокая прозрачность производимых искусственных роговиц позволяет использовать их в качестве полноценного аналога донорской роговице, в то время как механическая прочность позволяет надежно фиксировать роговицу в операционной зоне при помощи прошивания хирургической нитью и фиксации швами. Кроме того, на базе получения прозрачных коллагеновых мембран возможно производство прозрачных офтальмологических покрытий, которые также используются при ряде оперативных вмешательств в офтальмологии. Технология производства прозрачных коллагеновых мембран позволяет контролируемо стандартизировать толщину производимых искусственных роговиц: возможна разработка линейки имплантатов роговицы с различной толщиной (200, 400 и 600 мкм) для персонализированного лечения пациентов в зависимости от глубины поражения роговицы. Кроме того, персонализация будет достигаться за счет применения аутологичных клеток пациентов. Для производства полноценных биоэквивалентов роговицы с целью проведения полной (сквозной) кератопластики потребуется применение различных видов клеток (кератиноцитов, эндотелия) для воспроизведения нативной структуры роговицы.
o Разработан метод прогнозирования развития лучевых повреждений кожи после лучевой терапии у пациентов с раком молочной железы. На уровне доказательства концепции установлено прогнозирование развития ранних лучевых повреждений кожи после адъювантной дистанционной лучевой терапии у пациенток с раком молочной железы с помощью иммуннофенотипирования лимфоцитов периферической крови: при значениях иммунорегуляторого индекса до лучевой терапии выше 2,5, по результатам опредеяется прогностически неблагоприятная группа без предшествующей системной полихимиотерапии по развитию ранних лучевых повреждений кожи II-III степени на традиационную адъювантную дистанционную лучевую терапию в СОД 50 Гр. Прогнозирование развития ранних лучевых повреждений кожи после лучевой терапии у пациентов с раком молочной железы позволит персонализировать терапевтическую программу с оптимизацией планов лучевой терапии.
o Разрабатываются методы детекции хромосомных перестроек на основе технологий захвата конформации хромосом в целях преимплантационной диагностики эмбрионов человека. Разработана лабораторная методика, проведена оптимизация условий протокола. Получен материал для тестирования чувствительности и специфичности (более 100 эмбрионов из трех центров ЭКО). В данный момент проводится сборка и секвенирование Hi-C библиотек из этого материала.
o Разрабатывается метод репрограммирования зрелых гепатоцитов человека с помощью низкомолекулярных соединений. Целью разработки является получение длительно пролиферирующих клеток, обладающих признаками прогениторных за счет дедифференцировки зрелых человеческих гепатоцитов с помощью комбинаций малых молекул. Изучение их свойств и клинического потенциала позволит решить проблему клеточной компоненты при создании биоискусственной печени как эквивалентов донорской печени. Полученный результат является отправной точкой для дальнейших исследований, направленных на изучение свойств печеночных прогениторных клеток человека, разработку способов их получения с последующим применением в лечении терминальных стадий заболеваний печени. Стадия разработки – доказательство концепции.
o Разрабатывается матрикс на основе децеллюляризованной поджелудочной железы для повышения эффективности трансплантации островков Лангерганса. Получен и исследован тканеспецифический матрикс из фрагментов поджелудочной железы человека с выраженными признаками структурных изменений – признаками липоматоза и диффузным фиброзом, непригодных для трансплантации. Подтверждено сохранение в матриксе нативных компонентов, что позволяет создать условия для пролонгированной жизнедеятельности функционально активных островковых (инсулинпродуцирующих) клеток при создании КИК поджелудочной железы. Разработка относится к области тканевой инженерии поджелудочной железы, которая лежит в основе персонализированной медицины. Стадия разработки – доказательство концепции.
o Разрабатывается метод лечения рассеянного склероза с помощью искусственных микровезикул. Исследовали терапевтический потенциал микровезикул, полученных из клеток жировой ткани (ADMSCs), индуцированных цитохалазином B, экспрессирующих NGF (фактор роста нервов), на модели экспериментального аутоиммунного энцефаломиелита (ЭАЭ) у мышей. В исследовании показано достоверное уменьшение площади демиелинизации и числа реактивных астроцитов в сером веществе спинного мозга после введения микровезикул, по сравнению с группой без лечения, а также трансдуцированных микровезикул с терапевтическим фактором, по сравнению с нативными микровезикулами.
o Разрабатывается лекарственный препарат для генной терапии метахроматической лейкодистрофии на основе аденоассоциированных вирусов. Метахроматическая лейкодистрофия (МЛД) – аутосомно-рецессивное наследcтвенное нейродегенеративное заболевание, характеризующееся поражением миелиновой оболочки, покрывающей большинство нервных волокон центральной (ЦНС) и периферической нервной системы (ПНС). МЛД возникает вследствие дефицита лизосомного фермента арилсульфатазы A (ARSA), из-за различных мутаций в гене ARSA. Клинически МЛД проявляется прогрессирующей двигательной и когнитивной недостаточностью у пациентов. Разработаны 9 и 10 серотипы AAВ, кодирующие ген ARS и протестированы при интратекальном введении мини-свиньям. При исследовании тканей ЦНС с помощью ИГХ выявлена сверхэкспрессия ARSA в нейронах в мозжечке, спинном мозге и спинномозговых ганглиях.
o Разрабатывается метод лечения болезни Тея – Сакса с помощью генетически модифицированных мезенхимных стволовых клеток (МСК). GM2-ганглиозидозы представляют собой группу аутосомно-рецессивных лизосомных болезней накопления. Эти заболевания возникают в результате дефицита лизосомного фермента β-гексозаминидазы А (HexA). Дефицит HexA вызывает накопление GM2-ганглиозидов преимущественно в клетках нервной системы, что приводит к тяжелой нейродегенерации и нейровоспалению. Основа метода – кросс-коррекция дефицита β-гексозаминидазы А в мутантных клетках пациента с болезнью Тея – Сакса с использованием генетически модифицированных МСК. МСК были генетически модифицированы рекомбинантными аденоассоциированными вирусами, кодирующими кодон-оптимизированные гены α- и β-субъединиц фермента HexA (МСК-HEXA-HEXB). Показана способность МСК восстанавливать дефицит HexA в клетках пациента с болезнью Тея – Сакса (БТС) in vitro, также показана функциональность полученных клеток in vivo.
o Разрабатывается метод бесклеточной терапии рака молочной железы на основе индуцированных цитохалазином мембранных везикул мезенхимных стволовых клеток со сверхэкспрессией TRAIL. Лиганд, индуцирующий апоптоз, связанный с фактором некроза опухоли (TRAIL), является одним из наиболее перспективных среди терапевтических цитокинов, которые избирательно индуцирует апоптоз в опухолевых клетках. В данной работе мембранные везикулы (CIMVs) получали путем обработки цитохалазином В-нативных МСК и генетически модифицированных МСК-TRAIL (CIMVs-TRAIL). Противоопухолевый эффект CIMVs-TRAIL исследовали в модели рака молочной железы мыши. Перенос TRAIL в виде везикул позволит преодолеть устойчивость ряда опухолей у TRAIL-опосредованной индукции апоптоза.
o Разрабатывается метод терапии солидных опухолей анти-NKG2DL CAR-T клетками. Разработана концепция лекарственного препарата на основе анти-NKG2DL CAR-T клеток, специфично воздействующих на солпидные опухолевые клетки, экспрессирующие на поверхности соответствующие опухолевые антигены. В ходе работы получены генетические конструкции, кодирующие анти-CD19 и анти-NKG2DL рецепторы. Получены анти-CD19 и анти-NKG2DL CAR-T клеточные препараты, специфично воздействующие на опухолевые клетки. Проведена оценка эффективности анти-CD19 СAR-T клеток на 2D, 3D опухолево-подобных структурах и сфероидах. Проведена оценка эффективности анти-NKG2DL CAR-T клеток на 3D опухолево-подобных структурах, картриджном биореакторе Vitvo (Rigenerand), а также на первичных опухолевых клетках пациентов. В перспективе результаты могут быть применены для разработки персонализированных клеточных препаратов в трансляционных клинических проектах.
Разработаны протоколы для получения обкладочных клеток из обонятельной выстилки человека и получен патент РФ № 2676142 от 26 декабря 2018 г. Проведены доклинические исследования клеточного препарата на основе обкладочных клеток, доказана их безопасность и эффективность трансплантации в экспериментальные кисты спинного мозга. Подготовлен и подан пакет документов в Минздрав России для получения разрешения на клинические исследования.
o Разработаны клеточно-заселенные имплантаты для восстановления периодонта и костных дефектов, в том числе нижней челюсти. В Институте цитологии, совместно с Северо-Западным государственным медицинским университетом им. И.И. Мечникова, разработано два варианта конгруэнтных (соответствующих по форме дефекту) скаффолдов, заселенных стволовыми клетками пульпы зуба для применения в стоматологии и пародонтологии:
‒ Скаффолд на основе фибринового геля из плазмы крови пациента. По данным компьютерной томографии изготавливается на 3D-принтере заливочная форма, в которую заливается гель и суспензия клеток (стволовых клеток пульпы зуба или пародонтальных связок пациента), а также тромбин. После застывания геля получают гелеобразный имплантат, по форме соответствующий дефекту. Достоинством этого метода является отсутствие необходимости в биопринтере, а также использование аутологичных компонентов для скаффолда (за исключением тромбина). Недостатком является быстрое время резорбции скаффолда и малая его механическая жесткость. Такой имплантат может быть использован для ускорения регенерации после оперативных вмешательств на слизистой ротовой полости, лечении заболеваний пародонта, синуслифтинге при подготовке к установке зубного имплантата.
‒ Скаффолд на основе твердых пористых структур, состоящих из поликапролактона и гидроксиапатита и заселенный стволовыми клетками пульпы зуба или пародонтальных связок пациента (в зависимости от целей лечения и места установки). Скорость резорбции такого скаффолда соответствует скорости регенерации собственной костной ткани пациента, а его жесткость и прочность позволяет устанавливать его в участках с механической нагрузкой.
Эффективность скаффолдов была продемонстрирована в экспериментах in vivo (кролики, мыши) и in vitro. Разработана технология получения прототипа, начата подготовка документации для регистрации досье (разработана спецификация продукта, стандартные операционные процедуры (СОП), проведены переговоры с организациями, специализирующимися на проведении регистрационных доклинических исследований, в том числе БМКП).
o Разработана тканеинженерная конструкция на основе биополимеров и МСК для репарации уретры. Уникальность продукта определяется использованием нового многослойного биодеградируемого матрикса-мембраны, разработанной в Институте цитологии РАН. Уникальная мембрана разработана специально для использования в контакте с агрессивной средой во внутреннем просвете уретры и с живыми клеткам со стороны тканей. Тканеинженерная конструкция предназначена для применения в области хирургии уретры у мужчин при различных патологических состояниях, требующих восстановления просвета уретры (травмы, стриктуры, опухоли, ятрогенные повреждения уретры).
o Разрабатывается костно-эндотелиальный трансплантат с заданными свойствами для восстановления обширных дефектов, возникающих в результате травм, опухолевого роста, возраста: сегментные дефекты, незаживающие и вторичные переломы, опухоли периферической костной ткани. В основу создания продукта положены остеоиндутивные свойства эндотелия – способность передавать информацию соседствующим мезенхимным стволовым клеткам – паракринным и юкстакринным (физическое взаимодействие) способом. Для создания остеоиндуктивного эндотелиального клеточного продукта будет использована модификация эндотелиальных клеток с помощью генетических конструкций, несущих гены семейства Notch и (или) их партнеры. Для получения эндотелиальных клеток используются индуцированные плюрипотентные клетки, полученные от пациентов, что и определяет персонализированность продукта. В качестве альтернативы используются клетки эндотелия пуповинной вены как одного из самых доступных биоматериалов. Доставка клеточного продукта предполагается на основе известных в травматологии медленно биоразлагаемых композитных каркасов, изготовленных из поликапролактона медицинского качества (mPCL) с добавлением фосфатов кальция (гидроксиапатит (HA) и трикальцийфосфат (TCP).
o Разрабатывается персонализированная тест-система на основе нейронов, полученных методом прямого репрограммирования (трансдифференцировки) из клеток кожи. Одним из подходов персонализированной терапии является использование тест-систем на основе генетически идентичных донору клеток. Ввиду того, что получить нейроны из мозга конкретного больного для подобных исследований не представляется возможным, актуальным инструментом стало применение методов перепрограммирования клеток. В Институте цитологии РАН существенно усовершенствована методика получения среднешипиковых нейронов (СШН) человека методом трансдифференцировки из фибробластов кожи. Разработанная методика позволяет получать клетки с функциональной активностью, присущей СШН и экспрессией основных нейрональных маркеров. Полученные таким способом нейроны из фибробластов кожи больных болезнью Хантингтона демонстрируют фенотип, соответствующий данному заболеванию, в том числе агрегацию белка Хантингтина (Kraskovskaya et al., 2023). Преимуществом новой методики является высокая эффективность получения нейрональных клеток и относительно невысокая себестоимость. Применение методики прямого репрограммирования позволяет сохранить молекулярные маркеры, накапливаемые с возрастом донора, которые имеют особое значение при нейродегенеративных заболеваниях. Разработанная технология может быть использована для подбора наиболее эффективных фармацевтических препаратов, подходящих конкретному больному.
o Разработана концепция высокотехнологичных лекарственных препаратов для лечения ишемических заболеваний сердца и нижних конечностей на основе тканеинженерных конструкций, состоящих из клеточных пластов, сформированных из генетически модифицированных стволовых клеток (МСК), в которых направленно изменен секретом для придания им прорегенеративных, ангиогенных и антифиброзных свойств. МСК жировой ткани, генетически модифицированы векторами на основе аденоассоциированного вируса, несущими кДНК VEGF, HGF, SCF. Из модифицированных клеток получены клеточные пласты, эффективность которых доказана на моделях инфаркта у мыши и крысы и модели ишемии задней конечности у мыши. Установлено длительное сохранение жизнеспособности клеток при трансплантации в виде клеточных пластов, показана эффективность в плане стимуляции ангиогенеза, уменьшения фиброза, восстановления функции сердца, повышения выживаемости животных после инфаркта, восстановления кровотока в конечности и уменьшения некроза (ампутации) ишемизированной конечности.
Персонализированное применение обоих подходов возможно при использовании аутологичных МСК из различных депо (жировая ткань, костный мозг), а также при формировании клеточных пластов, по форме и модификации подходящих под конкретную клиническую ситуацию и состояние пациента с учетом факторов патогенеза.
Распоряжением Правительства от 18 марта 2023 г. № 620-р РНЦХ им. академика Б.В. Петровского включен в федеральный проект «Медицинская наука для человека» и реализует шесть мероприятий, пять из которых посвящены ММП:
1) Разработка метода получения и применения минимально манипулированных клеточных продуктов для лечения артроза коленного сустава (гонартроза). Технология позволяет добиться полного восстановления суставного хряща либо значительно отсрочить момент эндопротезирования. Четкие показания для применения ММП, а также кратность введения продукта будут уточнены в ходе проводимого исследования и планируемой в дальнейшем клинической апробации.
2) Разработка метода получения и применения минимально манипулированных клеточных продуктов для лечения асептического некроза головки бедренной кости. Асептический некроз (остеонекроз) головки бедренной кости (АНГБК)- прогрессирующее заболевание, являющееся причиной 5–12 % оперативных вмешательств по тотальному эндопротезированию тазобедренного сустава. Технология позволяет добиться полного купирования симптомов асептического некроза и восстановить поврежденную хрящевую ткань либо значительно отсрочить момент эндопротезирования. Четкие показания для применения ММП, а также кратность введения продукта будут уточнены в ходе проводимого исследования и планируемой в дальнейшем клинической апробации.
3) Разработка метода получения и применения минимально манипулированных клеточных продуктов для лечения переломов с задержкой консолидации. В структуре общей заболеваемости населения травмы занимают третье место; наиболее частыми видами травм являются переломы костей скелета (на них приходится более 20 % обращений за медицинской помощью). При этом до 10 % переломов длинных трубчатых костей сопровождается нарушениями консолидации вплоть до формирования ложного сустава. Частота несращений варьирует в зависимости от сегмента и может составлять 5–20 %. Технология позволяет добиться консолидации переломов за счет восстановления трофики и сформировать плотную костную мозоль. Четкие показания для применения ММП и кратность введения продукта будут уточнены в ходе проводимого исследования и планируемой в дальнейшем клинической апробации.
4) Разработка метода получения и применения минимально манипулированных клеточных продуктов для лечения осложнений болезни Крона в виде перианальных свищей. Болезнь Крона представляет собой аутоиммунное заболевание, относится к группе воспалительных болезней кишечника. Заболеваемость болезнью Крона варьируется от 0,3 до 16,5 случаев на 100 000 населения в год в зависимости от этиологии заболевания. Развитие перианальных фистул при болезни Крона является самой частой манифестирующей формой, что значительно снижает качество жизни пациента, вследствие наличия выраженного болевого синдрома, недержании кала, а также формирования абсцессов. Разрабатываемый метод лечения позволит добиться полного закрытия перианальных свищей и фистул, что значительно повысит качество жизни пациентов с болезнью Крона и предотвратит развитие широкого спектра осложнений.
5) Разработка медицинских изделий для получения минимально манипулированных клеточных продуктов. Разрабатываемые изделия позволят эффективно масштабировать технологии лечения на основе использования стромально-васкулярной фракции в широкий перечень медицинских организаций.
- В 2024 г. будут завершены клинические исследования, по результатам которых будут подготовлены предложения по корректировке клинических рекомендаций, в целях внесения в них технологий лечения, основанных на применении минимально манипулированных клеточных продуктов.
- Также в 2025 г. запланировано получение регистрационного удостоверения на медицинское изделие для получения ММП в условиях операционной. Такие изделия позволят масштабировать технологии применения ММП в другие медицинские организации.
- В 2026 г. планируется проведение серии протоколов клинической апробации разрабатываемых медицинских изделий для расширения показаний и внесения в клинические рекомендации технологий лечения ряда заболеваний ММП, полученными с использованием указанных медицинских изделий.